
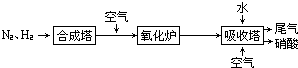
 、
、 、
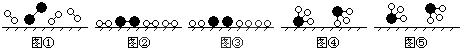
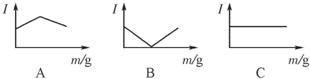
、 分别表示N2、H2、NH3,图⑤表示生成的NH3离开催化剂表面,则图③的含义是
分别表示N2、H2、NH3,图⑤表示生成的NH3离开催化剂表面,则图③的含义是 ?2NH3(g),设参加反应的氢气的物质的量xmol,原混合气体中 H2 和N2 按3:1(体积之比)混合,物质的量之比也是3:1,设氢气3nmol,氮气nmol,列式求算即可;
?2NH3(g),设参加反应的氢气的物质的量xmol,原混合气体中 H2 和N2 按3:1(体积之比)混合,物质的量之比也是3:1,设氢气3nmol,氮气nmol,列式求算即可;| c2(NH3) |
| c(N2).c3(H2) |
| c2(NH3) |
| c(N2).c3(H2) |
 ?2NH3(g),设参加反应的氢气的物质的量xmol,原混合气体中 H2 和N2 按3:1(体积之比)混合,物质的量之比也是3:1,设氢气3nmol,氮气nmol,则参加反应的氮气的物质的量为x/3mol,生成的氨气为2x/3mol,列式:
?2NH3(g),设参加反应的氢气的物质的量xmol,原混合气体中 H2 和N2 按3:1(体积之比)混合,物质的量之比也是3:1,设氢气3nmol,氮气nmol,则参加反应的氮气的物质的量为x/3mol,生成的氨气为2x/3mol,列式:
| ||||
n-
|
 ?2NH3(g)△H=-96kJ/mol,故答案为:N2(g)+3H2(g)
?2NH3(g)△H=-96kJ/mol,故答案为:N2(g)+3H2(g) ?2NH3(g)△H=-96kJ/mol;
?2NH3(g)△H=-96kJ/mol;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | HF | HClO | H2CO3 |
| 电离常数 25℃ | 3.53×10-4 | 2.95×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
| A、2ClO-+H2O+CO2=2HClO+CO22- |
| B、等物质的量浓度的 NaHCO3 和 NaClO 的混合溶液中,c(HCO3-)<c(ClO-) |
| C、等物质的量浓度的 NaHCO3 溶液和 Na2CO3 溶液中离子数目一定不相同 |
| D、等物质的量浓度的 NaF 和 NaClO 溶液中所含离子总浓度前者大于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:
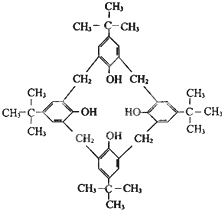 杯芳烃因分子形状与希腊圣杯相似而得名,对“特丁基杯芳烃”的结构简式如图所示,下列说法不正确的是( )
杯芳烃因分子形状与希腊圣杯相似而得名,对“特丁基杯芳烃”的结构简式如图所示,下列说法不正确的是( )| A、分子式是C40H54O4 |
| B、既能发生氧化反应,也与氢氧化钠溶液反应 |
| C、至少有9个碳原子在同一个平面上 |
D、可由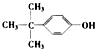 与HCHO缩合而成 与HCHO缩合而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5mol CO32- |
| B、0.5mol Na+ |
| C、6.02×1023个C |
| D、3.01×1023个O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下,将pH=2 H2SO4与pH=12 NH3?H2O溶液等体积混合后,混合液pH<7 |
| B、室温下,将pH=12 Ba(OH)2与pH=14 NaOH溶液等体积混合后,混合液13<pH<14 |
| C、室温下,将pH=13 Ba(OH)2与pH=1 HCl溶液等体积混合后,混合液的pH>7 |
| D、某温度下水的离子积为1×10-12,若使pH=1 H2SO4与pH=12 NaOH溶液混合后溶液呈中性,则两者的体积比 为1:10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com