
| A. | 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 | |
| B. | 核外电子排布由1s22s22p63s1-→1s22s22p6 的变化需要吸收能量 | |
| C. | 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 | |
| D. | 根据原子核外电子排布的特点,Cu在周期表中属于s区元素 |
分析 A、同一层即同一能级中的p轨道电子的能量一定比s轨道电子能量高,但外层s轨道电子能量则比内层p轨道电子能量高;
B、原子由1s22s22p63s1失去一个电子转变为1s22s22p6 的变化需要吸收能量;
C、N原子的2p轨道处于半满,第一电离能大于氧原子;
D、Cu的外围电子排布式为3d104S1,位于元素周期表的ds区.
解答 解:A、同一层即同一能级中的p轨道电子的能量一定比s轨道电子能量高,但外层s轨道电子能量则比内层p轨道电子能量高,故A错误;
B、核外电子排布由1s22s22p63s1,该原子处于基态钠原子,失去最外层一个电子转变成1s22s22p6为钠离子,所以由1s22s22p63s1→1s22s22p6 的变化需要吸收能量,故B正确;
C、N原子的2p轨道处于半满,第一电离能大于氧原子,故C错误;
D、Cu的外围电子排布式为3d104S1,位于元素周期表的ds区,故D错误;
故选B.
点评 本题考查原子核外电子排布规律及排布式的书写,题目难度不大,本题注意原子核外电子的排布和运动特点.


科目:高中化学 来源: 题型:选择题
| A. | ClO2的分子结构呈V型,属非极性分子 | |
| B. | ClO2中氯元素显+4价,具有很强的氧化性,其消毒效率(以单位体积得电子的数目表示)是Cl2的5倍 | |
| C. | ClO2、Cl2的稀溶液用于环境消毒,具有广谱高效的特点,对人畜无任何危害 | |
| D. | 常用Na2SO3在H2SO4的酸性条件下,还原NaClO3来制ClO2,这一反应的化学方程式可表示为Na2SO3+2NaClO3+H2SO4═2Na2SO4+2ClO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Z)=0.45 mol•L-1 | B. | c(Z)=1.20 mol•L-1 | C. | c(W)=1.00 mol•L-1 | D. | c(W)=0.80 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
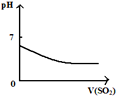
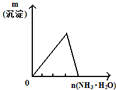
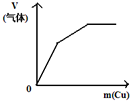
| 将二氧化硫通入到 一定量氯水中 | 将氨水滴入到一定量 氯化铝溶液中 | 将铜粉加入到一定量 浓硝酸中 | 将铁粉加入到一定量氯化铁溶液中 |
 |  |  | 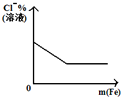 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com