
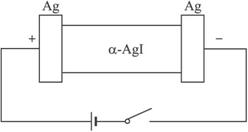
(1)铅蓄电池的正极电极方程式:(已知硫酸铅为难溶物)
____________________________________________________________________。
(2)若Ag+导电,α-AgI本身质量将____________(填“不变”“变大”或“变小”),电解池的阳极电极方程式:____________________________。
若I-导电,阳极附近的α-AgI晶体密度将会____________(填“不变”“变大”或“变小”)。
(3)若通电一段时间后铅蓄电池中消耗了1 mol H2SO4,则电解池的阴极增重____________ g。
(1)PbO2+4H++![]() +2e-====PbSO4+2H2O
+2e-====PbSO4+2H2O
(2)不变 Ag-e-====Ag+ 变大 (3)108
解析:(1)铅蓄电池放电反应中的氧化剂为PbO2,其在原电池正极上发生得电子的还原反应,据此可写出正极电极反应式为PbO2+4H++![]() +2e-====PbSO4+2H2O。(2)阳极电极反应式为Ag-e-
+2e-====PbSO4+2H2O。(2)阳极电极反应式为Ag-e-![]() Ag+,阴极电极反应式为Ag++e-
Ag+,阴极电极反应式为Ag++e-![]() Ag,由此可知。若Ag+导电,α-AgI中Ag+得失守恒,α-AgI本身质量将不变。若I-导电,I-移动至阳极后与此处生成的Ag+反应生成AgI,导致阳极附近的α-AgI晶体密度变大。(3)据电子得失守恒得关系式:
Ag,由此可知。若Ag+导电,α-AgI中Ag+得失守恒,α-AgI本身质量将不变。若I-导电,I-移动至阳极后与此处生成的Ag+反应生成AgI,导致阳极附近的α-AgI晶体密度变大。(3)据电子得失守恒得关系式:
Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O—2e-—2Ag
2PbSO4+2H2O—2e-—2Ag
2 mol 2×
1 mol 108 g


科目:高中化学 来源: 题型:
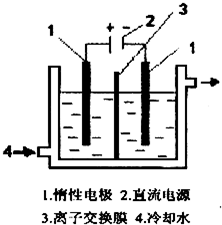 碘酸钾(KlO3)晶体是我国规定的食盐加碘剂.它 通常是以碘为原料与过量KOH溶液通过下列反应制 得:3I2+6K0H=5KI+KI03+3H20,再将 KI 和 KIO3 的混 合溶液电解,将其中的I-转化为IO-3,装置如图.
碘酸钾(KlO3)晶体是我国规定的食盐加碘剂.它 通常是以碘为原料与过量KOH溶液通过下列反应制 得:3I2+6K0H=5KI+KI03+3H20,再将 KI 和 KIO3 的混 合溶液电解,将其中的I-转化为IO-3,装置如图.| 实验操作 | 现象及结论 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 测定时间/小时钟 | 0 | 1 | 2 | 4 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |

| 32bc |
| a |
| 32bc |
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:
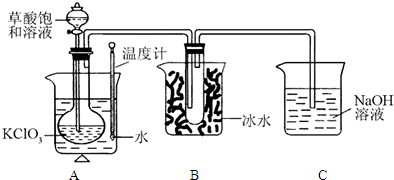
| 实验步骤 | 预期现象和结论 |
| 步骤1: |
|
| 步骤2: |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省惠州市高三第三次调研考试理综化学试卷(解析版) 题型:实验题
碘酸钾(KIO3)晶体是我国规定的食盐加碘剂。它通常是以碘为原料与过量KOH溶液通过下列反应制得:3I2+6KOH=5KI+KIO3+3H2O,再将 KI 和 KIO3的混合溶液电解,将其中的I―转化为IO3―,装置如图。
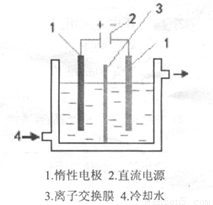
(1)在反应3I2+6KOH=5KI+KIO3+3H2O中,氧化剂和还原剂的物质的量之比为 。
(2)电解前,将KI和KIO3混合溶液加入阳极区;将氢氧化钾溶液加入阴极区。电解槽用水冷却。电解时,阳极上的电极反应 ;阴极上得到的气体产物为 ;
(3)某同学查资料获知:KIO3在酸性介质中与碘化物作用生成单质碘,该反应的离子反应方程式为 ,为确定电解是否完成,需检验阳极区电解液中是否含有I―,该同学选用淀粉溶液和稀硫酸进行实验,其它仪器及用品自选,请完成其方案:
|
实验操作 |
现象及结论 |
|
|
|
(4)电解完毕,从电解液中得到KIO3晶体的过程为:
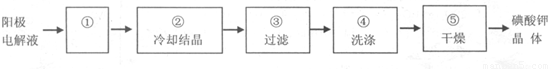
步骤①的操作名称 ,步骤④中洗涤晶体的目的 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com