

分析 I.铁离子具有氧化性,可以将Cu+氧化为Cu2+、将S2-氧化为S,过滤得到滤液1中含有CuCl2、剩余的FeCl3,得到的固体中含有S及SiO2,固体中加入苯,过滤得到硫的苯溶液,矿渣为SiO2,滤液水浴加热回收硫单质及苯;
在滤液中1加入铁,由于铁具有还原性,铁离子、铜离子具有氧化性,均可以与金属铁反应被还原,反应的离子反应方程式分别为:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Cu+Fe2+,再经过过滤,滤液2中溶质为FeCl2,沉淀1含有Cu及剩余的Fe,与足量的稀硝酸反应得到硝酸铜、硝酸铁,再加入CuO,调节溶液pH,使Fe3+转化为Fe(OH)3沉淀而从溶液中除去,再过滤得到滤液3为硝酸铜溶液,最后通过蒸发浓缩、冷却结晶得到硝酸铜晶体;
(4)根据电子转移守恒计算被氧化Cu2S的物质的量,进而计算被氧化的Cu原子的物质的量;
Ⅱ.(5)若是由于SO2显酸性引起的,向褪色的溶液中加入NaOH溶液,溶液变为红色,若是由于SO2有漂白性引起的,加热后恢复红色;
(6)装置D可证明SO2具有氧化性,则D中的溶液应具有还原性,可以选择H2S或Na2S,反应会有S生成;
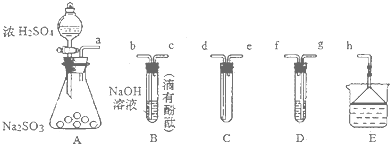
(7)A为二氧化硫制备装置,B为检验二氧化硫使滴有酚酞的氢氧化钠溶液褪色原理,D为检验二氧化硫的氧化性,两性质检验时,装置位置可以颠倒,E进行尾气处理,防止污染空气,C装置防止倒吸,应在A与B或C之间,注意C中气流方向为短进长出.
解答 解:I.铁离子具有氧化性,可以将Cu+氧化为Cu2+、将S2-氧化为S,过滤得到滤液1中含有CuCl2、剩余的FeCl3,得到的固体中含有S及SiO2,固体中加入苯,过滤得到硫的苯溶液,矿渣为SiO2,滤液水浴加热回收硫单质及苯;
在滤液中1加入铁,由于铁具有还原性,铁离子、铜离子具有氧化性,均可以与金属铁反应被还原,反应的离子反应方程式分别为:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Cu+Fe2+,再经过过滤,滤液2中溶质为FeCl2,沉淀1含有Cu及剩余的Fe,与足量的稀硝酸反应得到硝酸铜、硝酸铁,再加入CuO,调节溶液pH,使Fe3+转化为Fe(OH)3沉淀而从溶液中除去,再过滤得到滤液3为硝酸铜溶液,最后通过蒸发浓缩、冷却结晶得到硝酸铜晶体.
(1)由上述分析可知,沉淀1的成分是:Cu、Fe,故答案为:Cu、Fe;
(2)CuO的作用是:调节溶液pH,使Fe3+转化为Fe(OH)3沉淀而从溶液中除去,故答案为:调节溶液pH,使Fe3+转化为Fe(OH)3沉淀而从溶液中除去;
(3)从硝酸铜溶液中结晶得到Cu(NO3)2•nH2O时,需要通过蒸发浓缩、冷却结晶得到硝酸铜晶体,加热过程中Cu2+会水解,需要加入硝酸,防止铜离子水解,故①③错误、②④⑤正确,故答案为:①③;
(4)设被氧化的Cu2S为xmol,则根据电子转移守恒xmol×(1×2+2)=2mol×(3-2),解得x=0.5mol,故被氧化的Cu原子的物质的量为0.5mol×2=1mol,故答案为:1mol;
Ⅱ.(5)若是由于SO2显酸性引起的,向褪色的溶液中加入NaOH溶液,溶液变为红色,若是由于SO2有漂白性引起的,加热后恢复红色,具体方案为:取B中褪色后的溶液少许与试管中,向其中加入足量NaOH溶液,若溶液变红色(或取B中褪色后的溶液少许与试管中,加热不再变红色),则甲同学正确;
或者:将溶液加热,若溶液恢复红色,则说明乙同学正确,
故答案为:取B中褪色后的溶液少许与试管中,向其中加入足量NaOH溶液,若溶液变红色(或取B中褪色后的溶液少许与试管中,加热不再变红色),则甲同学正确;或者:将溶液加热,若溶液恢复红色,则说明乙同学正确;
(6)装置D可证明SO2具有氧化性,则D中的溶液应具有还原性,可以选择H2S或Na2S,反应会有S生成,现象是:D中溶液变浑浊或有淡黄色沉淀生成,
故答案为:H2S或Na2S;D中溶液变浑浊或有淡黄色沉淀生成;
(7)A为二氧化硫制备装置,B为检验二氧化硫使滴有酚酞的氢氧化钠溶液褪色原理,D为检验二氧化硫的氧化性,两性质检验时,装置位置可以颠倒,E进行尾气处理,防止污染空气,C装置防止倒吸,应在A与B或C之间,注意C中气流方向为短进长出,故仪器接口的连接顺序为a→edbcgfh或edgfbch,
故答案为:edbcgfh或edgfbch.
点评 本题考查制备方案设计、性质实验方案等,关键是明确工艺流程及性质实验方案原理,是对学生综合能力的考查,(4)中计算注意,铁离子同时氧化Cu+、S2-,需要学生具备知识的基础与灵活运用的能力,难度中等.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C、B、E、D、A | B. | B、D、A、C、E | C. | C、D、E、A、B | D. | C、E、B、D、A |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
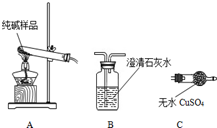 某实验小组模拟“侯氏制碱法”制纯碱,并进行以下探究:
某实验小组模拟“侯氏制碱法”制纯碱,并进行以下探究:| 选择的装置 (填编号) | 实验现象 | 实验结论 |
| AB或AC或ACB | B变浑浊或C变蓝或C变蓝、B变浑 | 样品含 NaHCO3 |
| 温度(℃) | 10 | 20 | 30 | 50 | 70 | 80 | 100 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 | 9.6 | 10.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 | |
| B. | 使用高效催化剂可有效提高正反应速率 | |
| C. | 反应达到平衡后,NO的反应速率保持恒定 | |
| D. | 升高温度可使该反应的逆反应速率降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X Y | Z |
| ①NaOH溶液 Al(OH)3 | 稀硫酸 |
| ②KOH溶液 SiO2 | 氢氟酸 |
| ③O2 N2 | H2 |
| ④FeCl3溶液 Cu | 浓硝酸 |
| A. | ①③ | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com