
 HCO3-+OH-。下列说法中,正确的是( )
HCO3-+OH-。下列说法中,正确的是( )
A.升高温度,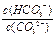 减小 减小 |
B.通入CO2,平衡向正反应方向移动 |
| C.稀释溶液,Na2CO3水解程度增大,水解平衡常数增大 |
| D.加入NaOH固体,平衡向逆反应方向移动,溶液pH减小 |
科目:高中化学 来源:不详 题型:填空题
 2SO3(g);△H=mkJ·mol-1
2SO3(g);△H=mkJ·mol-1


 NH3·H2O+H+,则该反应常温下的平衡常数K= (已知:常温下,
NH3·H2O+H+,则该反应常温下的平衡常数K= (已知:常温下, 的电离平衡常数Kb=1.7×10—5 mol·L—1)
的电离平衡常数Kb=1.7×10—5 mol·L—1)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 B(OCH3)3 +3H2O中,H3BO 3的转化率(
B(OCH3)3 +3H2O中,H3BO 3的转化率(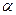 )在不同温度下随反应时间(t)的变化见图12,由此图可得出:
)在不同温度下随反应时间(t)的变化见图12,由此图可得出:
 _____0(填“<”、“=”或“>”).
_____0(填“<”、“=”或“>”). [B(O
[B(O H)4]-( aq)+H+(aq)已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)="2." 0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
H)4]-( aq)+H+(aq)已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)="2." 0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(g) + H2(g)反应,一定条件下达到平衡,①增大水蒸汽浓度,平衡向 反应方向移动(填“正”、“逆”或“不”下同),CO的浓度将 。(填“增大”、“减小”或“不变”下同)
CO(g) + H2(g)反应,一定条件下达到平衡,①增大水蒸汽浓度,平衡向 反应方向移动(填“正”、“逆”或“不”下同),CO的浓度将 。(填“增大”、“减小”或“不变”下同) N2O4(g) 当活塞迅速向外拉时,平衡向 反应方向移动,气体的颜色先变_____(“浅”、“深”或“不变”下同),后变______;最终和最初相比,_____更深(填“前”或“后”)。
N2O4(g) 当活塞迅速向外拉时,平衡向 反应方向移动,气体的颜色先变_____(“浅”、“深”或“不变”下同),后变______;最终和最初相比,_____更深(填“前”或“后”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 |
 2C(g)
2C(g)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO(g)+ H2O(g) △H =" Q" kJ·mol—1
CO(g)+ H2O(g) △H =" Q" kJ·mol—1| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
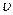 正(H2)=
正(H2)=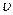 逆(CO) (d) CO2的质量分数不变
逆(CO) (d) CO2的质量分数不变 CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:| 时间(min ) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 2SO3(g),已知c始(SO2)=0.4mol/L,c始(O2)=1mol/L,经测定该反应在该温度下的平衡常数K=19。判断:当SO2转化率为50%时,该反应是否达到平衡状态,若未达到,向哪个方向进行?(要求写出计算过程)
2SO3(g),已知c始(SO2)=0.4mol/L,c始(O2)=1mol/L,经测定该反应在该温度下的平衡常数K=19。判断:当SO2转化率为50%时,该反应是否达到平衡状态,若未达到,向哪个方向进行?(要求写出计算过程)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com