
| A. | 烧碱 石灰石 石英 | B. | 纯碱 石灰石 石英 | ||
| C. | 纯碱 生石灰 石英 | D. | 纯碱 熟石灰 石英 |
分析 生产玻璃的原料是纯碱、石英和大理石;在玻璃熔炉中碳酸钙可以和二氧化硅之间发生反应生成硅酸钙和二氧化碳、碳酸钠可以和二氧化硅之间发生反应生成硅酸钠和二氧化碳;
普通玻璃成分是:二氧化硅,硅酸钠和硅酸钙.
解答 解:制造普通玻璃的主要原料是:纯碱、石灰石和石英,在玻璃熔炉中强热时的主要发生反应:SiO2+Na2CO3 $\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑、SiO2+CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑,普通玻璃成分是:二氧化硅,硅酸钠和硅酸钙,比例根据原料比例不同而不同.
故选B.
点评 本题考查学生化学和生活以及工业生产之间的关系,是一道理论和实际结合的题目,注意掌握玻璃的生产原理,题目难度不大.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:解答题
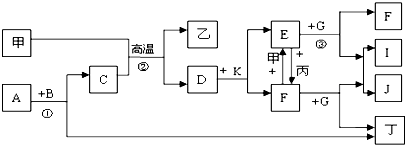
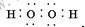 、甲在周期表中位置是第四周期第Ⅷ族;
、甲在周期表中位置是第四周期第Ⅷ族;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
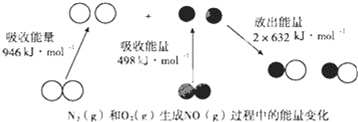
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量CO2通入澄清石灰水中:CO2+Ca2++2OH-═CaCO3↓+H2O | |
| B. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 用CH3COOH溶液溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑥⑧⑨ | B. | ①②⑤⑧ | C. | ①③④⑨ | D. | ②③⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
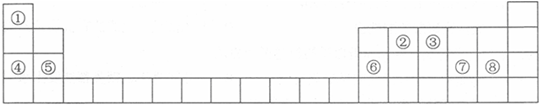
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 脂肪烃都能使溴水、酸性高锰酸钾溶液褪色 | |
| B. | 脂肪烃随碳原子数增多,氢元素的质量分数减小 | |
| C. | 脂肪烃密度都小于水的密度,都能发生氧化反应 | |
| D. | 脂肪烃的一氯代物都有两种或两种以上的结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com