
| A. | HX的电离方程式为:HX=H++X- | |
| B. | 该溶液中c(HX)>c (H+)>c (X-)>c (OH-) | |
| C. | 此溶液的pH=1 | |
| D. | NaX与HX的混合溶液pH=6时,溶液显酸性 |
分析 已知100℃时,水的离子积常数为1×10-12.100℃时0.1mol•L-1的HX溶液中,$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-6,则c(OH-)=1×10-9 mol•L-1,c(H+)=10-3 mol•L-1,氢离子浓度小于酸浓度,所以该酸是弱酸;
A.弱酸部分电离;
B.该酸部分电离,氢离子浓度小于酸浓度;
C.根据氢离子浓度计算pH;
D.根据Kw可知中性时pH=6.
解答 解:已知100℃时,水的离子积常数为1×10-12.100℃时0.1mol•L-1的HX溶液中,$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-6,则c(OH-)=1×10-9 mol•L-1,c(H+)=10-3 mol•L-1,氢离子浓度小于酸浓度,所以该酸是弱酸;
A.该酸是弱酸,弱酸部分电离,所以HX的电离方程式为:HX?H++X-,故A错误;
B.该酸部分电离,氢离子浓度小于酸浓度,溶液显酸性,则该溶液中c(HX)>c (H+)>c (X-)>c (OH-),故B正确;
C.由分析可知c(H+)=10-3 mol•L-1,则pH=3,故C错误;
D.水的离子积常数为1×10-12,则中性时c(OH-)=c(H+)=10-6 mol•L-1,即pH=6为中性,故D错误.
故选B.
点评 本题考查了弱酸的电离、pH的计算,正确推断酸的强弱是解本题关键,注意水的离子积常数只与温度有关,与溶液的酸碱性无关.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 熔化二氧化硅和金刚石时所克服的粒子间的作用力类型同种 | |
| B. | 原子晶体的熔点一定比金属的高 | |
| C. | 构成分子晶体的微粒一定含有共价键 | |
| D. | 晶体中只要有阳离子就一定有阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
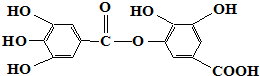
| A. | 常温下可以和Na2CO3溶液反应生成CO2气体 | |
| B. | 在碱性条件下水解,0.5mol该物质完全反应可以消耗4mol NaOH | |
| C. | 与稀H2SO4共热生成两种不同的有机物 | |
| D. | 该物质的化学式为C14H10O9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:
病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用碱石灰吸收SO2 | B. | CO2与澄清石灰水作用 | ||
| C. | N2O5与水反应制备HNO3 | D. | Na2O2与水反应制备氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液与氢氧化钡溶液混合:Cu2++2 OH-=Cu(OH)2↓ | |
| B. | 用小苏打(NaHCO3)治疗胃酸(主要成分是盐酸)过多:CO32-+H+═CO2↑+H2O | |
| C. | 将少量二氧化碳气体通入澄清石灰水中:2OH-+CO2═CO32-+H2O | |
| D. | 稀硫酸与氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直径介于1nm~100 nm之间的微粒称为胶体 | |
| B. | 电泳现象可证明胶体带电 | |
| C. | 用盐析法可分离皂化反应后所得的产物 | |
| D. | 用含1mol FeCl3的溶液可制得6.02×1023个Fe(OH)3胶体粒子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com