
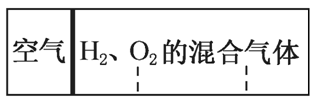
整个容积的1/4)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆。活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来H2、O2的体积之比可能为( )
A.2:7 B.5:4
C.2:1 D.7:2
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
下列涉及的有机物及有机反应类型错误的是
A.乙烯分子与苯分子中碳碳键不同,但二者都能发生加成反应
B.酯、蛋白质、纤维素都能发生水解反应
C.苯、乙醇和乙酸都能发生取代反应
D.1 mol乙醇与1 mol乙酸在一定条件下,发生酯化反应可生成1 mol乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
阿伏加德罗常数约为6.02×1023 mol-1,下列说法正确的是( )
A.2.3 g钠与足量丙三醇反应,转移电子数为0.3×6.02×1023
B.标准状况下,22.4 L乙醇的共价键数为8×6.02×1023
C.标准状况下,5.6 L甲醛所含的电子数为4×6.02×1023
D.100 mL 1 mol·L-1醋酸溶液中,H+的个数为0.1×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.1 mol Na2O2固体中含有的O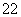 数为2NA
数为2NA
B.常温常压下,3.2 g CH4中含有的电子数为2NA
C.标准状况下,11.2 L CH3CH2OH中含有的分子数为0.5NA
D.100 mL 1 mol·L-1的CH3COOH溶液中含有的CH3COOH分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
若NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.1 mol Na2CO3·10H2O晶体中,阴离子总数大于0.1NA
B.常温常压下,18 mL水中所含氢离子数约为10-7NA
C.标准状况下,22.4 L氦气中含有的原子数约为NA
D.23 g组成为C2H6O的有机物,C—H键数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
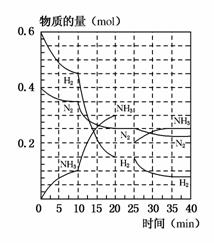
500 ℃、20 MPa时,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示(10 min时达到第一次平衡),下列说法正确的是( )
A.反应开始到第一次平衡时,N2的平均反应速率为0.005 mol/(L·min)
B.从曲 线可以看出,反应进行到10 min至20 min时可能是使用了催化剂
线可以看出,反应进行到10 min至20 min时可能是使用了催化剂
C.从曲线可以看出,反应进行至25 min时,增加了0.1 mol 的氨气
D.在25 min时平衡正向移动但达到新平衡后NH3的体积分数比原平衡小
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇。写出相应反应的化学方程式_______________________________________________________________。
(2)已知:甲醇脱水反应 2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH1=-23.9 kJ·mol-1
甲醇制烯烃反应 2CH3OH(g)===C2H4(g)+2H2O(g) ΔH2=-29.1 kJ·mol-1
乙醇异构化反应 C2H5OH(g)===CH3OCH3(g)
ΔH3=+50.7 kJ·mol-1
则乙烯气相直接水合反应C2H4(g)+H2O(g)===C2H5OH(g)的ΔH=________kJ·mol-1。与间接水合法相比,气相直接水合法的优点是__________________________。
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系[其中n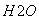 :n
:n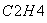 =1:1]
=1:1]
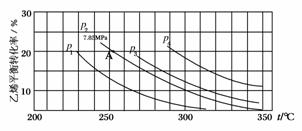
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②图中压强p1、p2、p3、p4的大小顺序为:________,理由是:______________________。
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃,压强6.9 MPa,n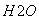 :n
:n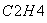 =0.6:1。乙烯的转化率为5%。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有:________________、________________。
=0.6:1。乙烯的转化率为5%。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有:________________、________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某混合溶液中含有等物质的量的CuSO4、FeSO4、Fe2(SO4)3。已知下表数据:
| 物质(25℃) | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
| 完全沉淀时的pH | ≥6.4 | ≥9.6 | 3~4 |
下列叙述正确的是( )
A.混合溶液中:c(SO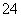 )[c(Cu2+)+c(Fe2+)+c(Fe3+)]=54
)[c(Cu2+)+c(Fe2+)+c(Fe3+)]=54
B.若向混合溶液中加入铁粉,不可能观察到红色固体析出
C.若向混合溶液中加入足量氯水,调节pH到3~4后过滤,得到纯净的CuSO4溶液
D.若向混合溶液中逐滴加入烧碱溶液,首先生成Fe(OH)3沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
c(H+)相同的等体积的两份溶液A和B;A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出的氢气的质量相等,则下列说法正确的是( )
①反应所需要的时间B>A②开始反应时的速率A>B③参加反应的锌的物质的量A=B④反应过程的平均速率B>A⑤盐酸里有锌剩余⑥醋酸里有锌剩余
A ③④⑤ B ③④⑥ C ②③⑤ D ②③⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com