
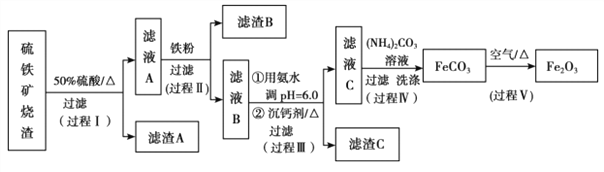
【题目】某课题组以硫铁矿烧渣(含 Fe2O3、 Fe3O4、 Al2O3、 CaO、 SiO2 等)为原料制取软磁用 Fe2O3(要求纯度>99.2%, CaO 含量<0.01%)。其工艺流程如下(所加入试剂均稍过量):
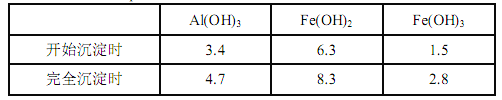
已知:生成氢氧化物的 pH 如下表所示
(1)滤渣 A 的主要成分是__________。
(2)在过程Ⅱ中可观察到产生少量气泡,溶液颜色慢慢变浅。能解释该实验现象的离子方程式有__________。
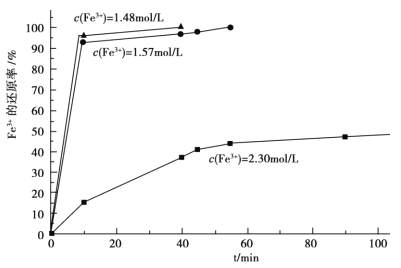
(3)在过程Ⅱ中,课题组对滤液 A 稀释不同倍数后,加入等质量的过量铁粉,得出 Fe3+浓度、还原率和反应时间的关系如图所示:结合上述实验结果说明:课题组选择稀释后c(Fe3+)为 1.60mol/L 左右的理由是______。
(4)在过程Ⅲ中,课题组在相同条件下,先选用了不同沉钙剂进行实验,实验数据见下表:(已知:滤液 B 中钙的含量以 CaO 计为 290—310mg/L)
沉钙剂 | Na2SO3 | H2C2O4 | (NH4)2CO3 | Na2CO3 | NH4F |
用量/g | 2 | 2 | 2 | 5 | 2 |
剩余CaO/mg/L) | 290 | 297 | 290 | 190 | 42 |
根据实验结果, 选择适宜的沉钙剂,得到滤渣 C 的主要成分有__________。
(5)在过程Ⅳ中,反应温度需要控制在 35℃以下,不宜过高,其可能的原因是__________。
(6)在过程Ⅴ中,反应的化学方程式是__________。
【答案】 SiO2 Fe+2H+=Fe2++H2↑ Fe+2Fe3+=3Fe2+ c(Fe3+)在1.60mol/L左右时,反应速率更快,Fe3+的还原率更高 CaF2、Al(OH)3 温度过高,(NH4)2CO3易分解 4FeCO3+O2![]() 2Fe2O3+4CO2↑
2Fe2O3+4CO2↑
【解析】试题分析:由题中流程可知,烧渣在加热的条件下经硫酸浸取后,过滤除去不溶物二氧化硅后,向滤液A中加入足量铁粉把Fe3+还原为Fe2+,过滤得滤液B,向滤液B中加入氨水调到pH=6.0,使Al3+完全转化为氢氧化铝沉淀,然后加入沉淀剂并加热,待滤液中Ca2+完全沉淀后过滤,向滤液C中加入碳酸铵溶液,过滤、洗涤,得到碳酸亚铁,最后将碳酸亚铁在空气中加热得到氧化铁。
(1)浇渣中只有SiO2不溶于硫酸,故滤渣 A 的主要成分是SiO2。
(2)在过程Ⅱ中可观察到产生少量气泡,溶液颜色慢慢变浅。该过程共有两个离子反应发生,其离子方程式为Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑。
(3)由Fe3+浓度、还原率和反应时间的关系曲线可知,c(Fe3+)在1.60mol/L左右时,反应速率更快(在很短的时间内达到很高的还原率),Fe3+的还原率更高,故课题组选择稀释后c(Fe3+)为 1.60mol/L左右。
(4)由表中实验数据可知,在相同的条件下,选择NH4F作为沉钙剂时,滤液B中钙的含量最低,故应选择NH4F作为沉钙剂,得到滤渣 C 的主要成分有CaF2、Al(OH)3。
(5)在过程Ⅳ中,使用了碳酸铵作为沉淀剂,反应温度需要控制在35℃以下,不宜过高,其可能的原因是:温度过高,(NH4)2CO3易分解。
(6)在过程Ⅴ中,碳酸亚铁在空气中加热得到氧化铁,反应的化学方程式是4FeCO3+O2![]() 2Fe2O3+4CO2↑ 。
2Fe2O3+4CO2↑ 。


科目:高中化学 来源: 题型:
【题目】某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物![]() 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物![]() 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是
A. 溶液A和B均可以是盐酸或氢氧化钠溶液
B. 溶液A和B均可以选用稀硝酸
C. 若溶液B选用氯化铁溶液,则实验难以实现
D. 实验方案Ⅱ更便于实施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应化学平衡常数的表达式:K=_______________________________;
(2)该反应为________(填“吸热”或“放热”)反应;
(3)下列说法中能说明该反应达平衡状态的是__________
A、容器中压强不变
B、混合气体中c(CO)不变
C、混合气体的密度不变
D、c(CO) = c(CO2)
E、单位时间内生成CO的分子数与生成H2O的分子数相等
(4)某温度下,各物质的平衡浓度符合下式:c(CO2)×c(H2)=c(CO)×c(H2O),试判此时的温度为__________℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72-的酸性废水通过铁炭混合物,在微电池正极上Cr2O72-转化为Cr3+,其电极反应式为______________________________________。
(2)氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。与汽油相比,氢气作为燃料的优点是_____________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:__________________________________。
(3)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2===Fe+2Li2S,正极反应式是_____________________________。
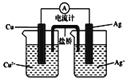
(4)右图所示原电池正极的反应式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用稀硫酸与过量锌块反应制取氢气,欲加快化学反应速率而不改变产生氢气的量,下列措施不可行的是( )
A.升高温度B.改用等质量的锌粉
C.滴加少量硫酸铜溶液D.滴加少量稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由U形管、铁棒、碳棒和CuCl2溶液组成如图所示装置,下列说法不正确的是
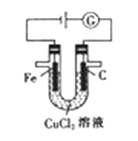
A. 铁棒为阴极,碳棒为阳极
B. 阴极的电极反应式为Cu2++2e-==Cu
C. 转移0.2mol电子时,阳极生成2.24L气体
D. 若将碳棒换成铜棒,可实现在铁棒上镀铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C1O2作为一种强氧化剂,是国际上公认的高效消毒灭菌剂,但因其易爆有毒,常用NaClO2替代。常温下,将NaOH固体加入到由0.1molC1O2溶于水配成的1L溶液中。溶液pH及部分组分含量变化曲线如图,下列叙述不正确的是

(已知:2C1O2+H2O![]() HC1O2+H++C1O3-)
HC1O2+H++C1O3-)
A. Ka(HClO2)≈10-4.5
B. 不能用pH试纸测该溶液的pH
C. 酸性:HClO2<HClO3,氧化性:HClO2>HClO3
D. 该图像上任何一点,都有c(C1O2-)+c(HC1O2)+c(C1O3-)=0.1mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com