


 ;氢与氧形成极性键,氧与氧形成非极性键,故答案为:
;氢与氧形成极性键,氧与氧形成非极性键,故答案为: ;极性;非极性;
;极性;非极性;

 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:阅读理解
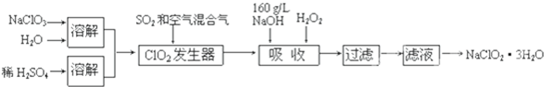
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试管编号 | A | B | |
| 步骤 | 1 | 5mL过氧化氢溶液 | 5mL过氧化氢溶液 |
| 2 | 5滴过氧化氢酶溶液 | 5滴 H2O | |
| 3 | 有气泡产生 | 无气泡产生 | |
查看答案和解析>>
科目:高中化学 来源:广东省执信中学2011-2012学年高二上学期期中考试化学文科试题 题型:013
|
下列关于名称与化学用语表述正确的是 | |
| [ ] | |
A. |
乙稀:CH2=CH2 |
B. |
过氧化氢:H2O |
C. |
乙醇:CH3CHO |
D. |
乙酸:CH3COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com