
【题目】恒温25℃下,向一定量的0.1mol/L的BOH溶液中逐滴滴入稀盐酸。溶液中水电离出的氢离子浓度的负对数[用pC表示,pC=-1gc(H+)水]与加入盐酸体积的关系如图所示。下列叙述错误的是( )

A. BOH为弱碱且Kb的数量级为10—5
B. b点溶液呈中性
C. c-d点间溶液中:c(BOH)+c(OH—)>c(H+)
D. c点溶液中水的电离程度最大,且c(B+)<c(Cl—)
【答案】C
【解析】
A.由a点可知BOH电离出c(OH—)=10-14/10-11.3=10-2.7mol/L,则![]() ,则Kb的数量级为10—5,A项正确;
,则Kb的数量级为10—5,A项正确;
B.25℃下, b点c(H+)水=10-7mol/L ,此时为BOH和BCl的混合液,BOH对水的电离的抑制程度与BCl对水的电离的促进程度相同,则pH=7,即b点溶液呈中性,故B正确;
C.c点水的电离达到最大值,则此时溶质为BCl,由质子守恒有c(BOH)+c(OH—)=c(H+),c-d点过程中继续加盐酸,c(OH—)减小而c(H+)增大,则c(BOH)+c(OH—)<c(H+),C项错误;
D.c点水的电离程度最大,此时溶质为BCl,B+水解使溶液显酸性,则c(B+)<c(Cl—),D项正确。
本题选C。


科目:高中化学 来源: 题型:
【题目】(1)3.01×1023个氯气分子的物质的量是________,氯原子的物质的量是________。
(2)1.5mol Na2SO4·10H2O中所含的Na+的物质的量是________,所含的SO42-的物质的量是________,所含H2O的数目是______。
(3)一定量的Na2CO3中,碳原子和氧原子的物质的量之比为______。
(4)0.5mol NaOH中含有电子的物质的量是__________,在________mol Na2CO3中所含Na+数目与上述0.5mol NaOH所含Na+数目相等。
(5)12.4g Na2R含0.4mol Na+,则Na2R的摩尔质量为_______,R的相对原子质量为________。含R的质量为1.6g的Na2R,其物质的量为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以方潜矿(PbS)为原料制备铅蓄电池的电极材料的工艺流程如图所示:

部分化合物的Ksp如下表所示:
物质 | PbCl2 | PbS | PbCrO4 |
Ksp | 1.2×10-5 | 9.0×10-29 | 1.8×10-14 |
请回答下列问题:
(1)“焙烧”生成的气体可用于工业制备____________。
(2)写出“高温还原”的主要化学方程式:____________。
(3)“粗铅”的杂质主要有锌,铁,铜,银等,电解精炼时阴极反应式为____________。阳极泥的主要成分为____________。
(4)铅与稀盐酸反应产生少量气泡后反应终止,原因是____________。写出制备PbO2的离子方程式:____________。
(5)Pb(NO3)2是强酸弱碱盐,氢硫酸(H2S)是弱酸,向Pb(NO3)2溶液中通入H2S气体是否能产生黑色PbS沉淀____________?(列式计算说明,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1×10-15)。
(6)将PbCrO4加入足量硝酸中,部分振荡,观察到主要现象是____________,反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辣椒的味道主要源自于所含的辣椒素,具有消炎、镇痛、麻醉和戒毒等功效,特别是其镇痛作用与吗啡相若且比吗啡更持久。辣椒素(F)的结构简式为 ,其合成路线如下:
,其合成路线如下:

已知:R-OH![]() R-Br R-Br+R’-Na
R-Br R-Br+R’-Na ![]() R’-R+NaBr
R’-R+NaBr
回答下列问题:
(1)辣椒素的分子式为___________,A所含官能团的名称是___________,D的最简单同系物的名称是___________;
(2)A→B的反应类型为___________,写出C→D的化学方程式___________;
(3)写出同时符合下列三个条件的D的同分异构体的结构简式:___________;
①能使溴的四氯化碳溶液褪色
②能发生水解反应,产物之一为乙酸
③核磁共振氢谱为三组峰,且峰面积比为3︰2︰1
(4)4-戊烯酸(CH2=CHCH2CH2COOH)可用作农药、医药中间体。参照以上合成路线,设计由CH2=CHCH2OH为起始原料制备4-戊烯酸的合成路线___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在化肥、医药、炸药、材料等领域中有着极其重要用途。
(1)羟氨能与溴化银悬浊液反应:2NH2OH+2AgBr=N2↑+2Ag+2HBr+2H2O,羟氨的电子式为________;反应中烃氨表现________性.
(2)已知:a.N2(g)+3H2(g)=2NH3(g) △H=-92.2kJ/mol
b.H2(g)+Cl2(g)=2HCl(g) △H=-184.6kJ/mol
c.2NH3(g)+3Cl2(g)=N2(g)+6HCl(g) △H3
①△H3________.
②反应c在常温下能快速进行的原因为________.
(3)容积均为1L的甲、乙两个容器,其中甲为绝热容器,乙为恒温容器.相同温度下,分别充入0.2mol的NO2,发生反应:2NO2(g)≒N2O4(g) △H<0,甲中NO2的相关量随时间变化如下图所示。
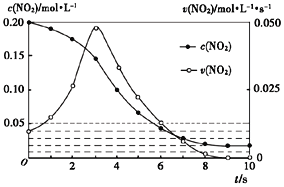
①0~3S内,甲容器中NO2的反应速率增大的原因是________.
②甲达平衡时,温度若为T℃,此温度下的平衡常数Kc=________.
③平衡时,K甲________K乙(填“>”、“<”或“=”,下同),P甲________P乙
(4)化学工作者对NO与H2的反应进行研究,提出下列3步机理:(k为速率常数)
第一步2NO=N2O2 快反应,平衡时:V正=K正·c2(NO)=V逆=K逆·c(N2O2)
第二步N2O2+H2==N2O+H2O 慢反应 第三步N2O+H2=N2+H2O 快反应
其中可近似认为第二步反应不影响第一步平衡,下列说法正确的是________.(填字母标号)
A.V(第一步逆反应)<V(第二步反应) B.总反应快慢主要由第二步反应决定
C.达平衡时,2c(NO)=c(N2O2) D.第一步反应的平衡常数K= K正/ K逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4与Cl2生成CH3Cl的反应过程中,中间态物质的能量关系如下图所示(Ea表示活化能),下列说法不正确的是

A. 已知Cl·是由Cl2在光照条件下化学键断裂生成的,该过程可表示为:![]()
B. 相同条件下,Ea越大反应速率越慢
C. 图中ΔH<0,其大小与Ea1、Ea2无关
D. CH4转化为CH3Cl的过程中,所有C-H发生了断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对下列实验现象表述不正确的是
A. 用同一针筒先后抽取80 mL氯气、20 mL水,振荡,气体完全溶解,溶液变为黄绿色
B. 在表面皿中加入少量胆矾,再加入3 mL浓硫酸,搅拌,固体由蓝色变白色
C. 向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀
D. 将点燃后的镁条伸入充满二氧化碳的集气瓶,镁条剧烈燃烧,有白色、黑色固体生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需用44.8 L(标准状态)CO2 ,现用含CaCO3 90%石灰石与足量的盐酸反应,问:
(1)至少需要这种石灰石多少克______?
(2)生成CaCl2物质的量是多少______?
(3)反应消耗5mol/L的盐酸多少毫升______?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com