
【题目】柠檬烯是一种食用香料,其结构简式如图所示。下列有关柠檬烯的分析正确的是( )
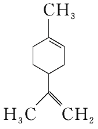
A. 它的一氯代物有6种
B. 它的分子中所有的碳原子一定在同一平面上
C. 它和丁基苯![]() 互为同分异构体
互为同分异构体
D. 一定条件下,它分别可以发生加成、取代、氧化、还原等反应
科目:高中化学 来源: 题型:
【题目】H2和CO合成甲醇反应为:CO(g)+2H2(g)![]() CH3OH(g)(正反应是放热反应)。在恒温,体积为2L的密闭容器中分别充入1.2molCO和1molH2,10min后达到平衡,测得含有0.4molCH3OH(g)。则达到平衡时CO的浓度为___;10min内用H2表示的化学反应速率为___;若要加快CH3OH的生成速率并提高CO的转化率,可采取的措施有___(填一种合理的措施)。
CH3OH(g)(正反应是放热反应)。在恒温,体积为2L的密闭容器中分别充入1.2molCO和1molH2,10min后达到平衡,测得含有0.4molCH3OH(g)。则达到平衡时CO的浓度为___;10min内用H2表示的化学反应速率为___;若要加快CH3OH的生成速率并提高CO的转化率,可采取的措施有___(填一种合理的措施)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl-,降低对电解的影响,反应原理如下:Cu(s)+Cu2+(aq)![]() 2Cu+(aq) ΔH1=akJ/mol;Cl-(aq)+Cu+(aq)
2Cu+(aq) ΔH1=akJ/mol;Cl-(aq)+Cu+(aq)![]() CuCl(s) ΔH2=bkJ/mol,实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。下列说法正确的是( )
CuCl(s) ΔH2=bkJ/mol,实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。下列说法正确的是( )
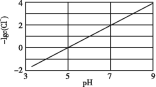
A. 溶液pH越大,Ksp(CuCl)增大
B. 向电解液中加入稀硫酸,有利于Cl-的去除
C. 反应达到平衡后,增大c(Cu2+),c(Cl-)减小
D. ![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl-(aq)
Cu2+(aq)+Cl-(aq)![]() CuCl(s)的ΔH=(a+2b)kJ/mol
CuCl(s)的ΔH=(a+2b)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A. 0.3 mol Cu与足量稀硝酸充分反应,可收集到4.48L气体
B. 由NO2和N2O4组成的混合物46g中共含有2NA个N原子
C. 常温常压下,16g甲烷分子中所含质子数为10NA
D. 0.2mol/L的NH4NO3溶液中所含N原子的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源、信息、材料是新科技革命的三大支柱,现有一种叫HEMA的材料,是用来制备软质隐形眼镜的,其结构简式如图,则合成它的单体为( )
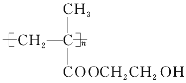
A. CH3—CH=CH—COOH CH3CH2OH
B. 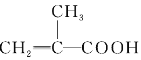 HOCH2CH2OH
HOCH2CH2OH
C. CH2=CH—CH2COOH HOCH2CH2OH
D. 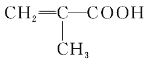 CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠、碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:____。
(2)在钠、碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是_____。
(3)吸收液吸收SO2的过程中,pH随n(SO32-)∶n(HSO3-)变化关系如表:
n(SO32-)∶n(HSO3-) | 91∶9 | 1∶1 | 1∶91 |
pH | 8.2 | 7.2 | 6.2 |
上表判断NaHSO3溶液显___性,用化学平衡原理解释:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100mL甲气体依次通过下图实验的处理,结果得到酸性溶液,几乎无气体剩余,则甲气体的组成为

A.NH3、NO2、N2B.NH3、NO、CO2
C.NH3、NO2、CO2D.NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,1L 1mol/LHF溶液中含HF分子数目为NA
B.2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g) △H=-a kJ·mol-1,将2mol CO2和6mol H2在一密闭容器中按照上述反应充分反应放出a kJ的热量
CH3CH2OH(g)+3H2O(g) △H=-a kJ·mol-1,将2mol CO2和6mol H2在一密闭容器中按照上述反应充分反应放出a kJ的热量
C.78gNa2O2固体中含阴离子数目为NA
D.25g质量分数68%的H2O2水溶液中含氧原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】J、M、Q、R、T、X、Y、Z为前四周期原子序数依次增大的8种元素(不包含0族元素)。J的原子半径是周期表所有元素中最小的,M基态原子的3个能级所含电子数相同,R的基态原子2p能级上未成对电子数与M相同,T的基态原子含13种运动状态不同的电子,X与R位于同一主族,Y的基态原子最外层有7个电子,Z的基态原子最外层电子数是次外层的1/7。(回答问题时用字母对应的元素符号)

⑴基态Z2+的核外电子排布式是______。
⑵Q、R、X的第一电离能由大到小的顺序是______。
⑶X8的结构如图甲所示,其熔沸点均高于XR2,原因是______。
⑷气态XR3以单分子形式存在,其分子的立体构型为______;固体XR3中存在如图乙所示的三聚分子,该分子中X原子的杂化轨道类型为______。
⑸不考虑配离子[T(RJ)4]-的空间构型, [T(RJ)4]-的结构式可以表示为______。(用“→”表示其中的配位键)
⑹由T、Q原子形成的晶体晶胞如图丙所示,相邻T、Q原子间以共价键相连接。该晶体的化学式为______,预测该晶体熔点高或低,并说明理由:_____。
⑺ZX2晶体的晶胞如图丁所示,距离每个Z2+最近的Z2+的个数是______。
⑻JY易溶于水的原因是______。
⑼1 mol MR(QJ2)2中所含σ键的数目是______。
⑽MQR-的中心原子的轨道杂化类型是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com