
【题目】在标况下,m克气体A和n克气体B的分子数相等,下列说法正确的是
A.同体积的气体A和气体B的质量比为m:n
B.25℃时,1kg气体A和1kg气体B的分子数比为m:n
C.同温同压下,气体A和气体B的密度比为n:m
D.标准状况下,等质量的气体A和气体B的体积比为n:m
【答案】D
【解析】
在标准状况下,mgA气体与ngB气体分子数相等,分子数相同,则物质的量相同,根据![]() ,则A气体与B气体的摩尔质量之比为m:n;根据pV=nRT,pV=
,则A气体与B气体的摩尔质量之比为m:n;根据pV=nRT,pV=![]() RT,pM=
RT,pM=![]() RT=ρRT分析;
RT=ρRT分析;
A.根据pV=nRT,同温同压,同体积的气体质量之比等于摩尔质量之比,所以同体积的气体A和气体B的质量比为m:n,但是选项中没有说明气体所处的温度和压强,所以不能去确定,A错误;
B.相同质量,分子数与摩尔质量成反比,所以1kg气体A与1kg气体B的分子数之比为n:m,B错误;
C.同温同压下,气体A与气体B的密度之比等于摩尔质量之比,所以气体A与气体B的密度之比为m:n,C错误;
D.同温同压,相同质量的气体体积与摩尔质量成反比,所以标准状况下,等质量的A与B的体积比为n:m,故D正确;
答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应,B、C、F都是气态单质,且B为黄绿色;反应③中有水生成,反应②需要放电才能发生,A和D相遇有白烟生成。
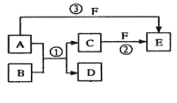
(1)反应③的化学方程式为:_________________;
(2)反应①中每生成1 molC,转移的电子数为______________;
(3)A与D的水溶液恰好完全反应时,其生成物的水溶液呈_____性(填“酸”“碱”或“中”),该水溶液中存在着如下关系,用粒子浓度符号填写。
①c(H+)+____= c(OH-)+ c(Cl-);
②c(H+)= c(OH-)+____;
(4)元素X与组成B的元素同周期,X的单质既可与酸反应也可与碱反应且都生成H2,则
①X的单质与碱反应的离子方程式_____________________________;
②X、空气、海水可以组成新型海水标志灯的电池。该电池以海水为电解质溶液,靠氧气使X不断氧化而源源不断产生电流,只要把灯放入海水中,数分钟后就会发出耀眼的闪光,其能量比干电池高20~50倍。则该新型电池的正极的电极反应式为________________;原电池的总反应方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物A(C8H8O2)为一种无色液体.从A出发可发生如图的一系列反应.则下列说法正确的是( )
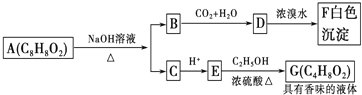
A.上述各物质中能发生水解反应的有A、B、D、G
B.根据图示可推知D为苯酚
C.A的结构中含有碳碳双键
D.G的同分异构体中属于酯且能发生银镜反应的只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
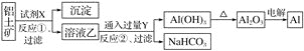
下列叙述不正确的是( )
A.试剂X可以是氢氧化钠溶液
B.反应①过滤后所得沉淀为氧化铁
C.图中所示转化反应包含氧化还原反应
D.反应②的化学方程式为2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成气态分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期元素中原子半径最大的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子。则
(1)X的化学名称为__________。
(2)B单质的结构式为__________;E的气态氢化物的电子式为__________;C与D形成的两种化合物中,其中一种物质含有两种类型的化学键,分别为______________,该物质属于______________(填“离子化合物”或“共价化合物”)。
(3)B、C、E分别与A形成的化合物中最稳定的是__________(写化学式)。
(4)D是同周期简单阳离子中离子半径最__________(填“大”或“小”)的元素。
(5)F的单质在反应中常作________剂(填“氧化”或“还原”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为3∶1)直接作燃料,其工作原理如图所示,并以此电源用于工业生产。
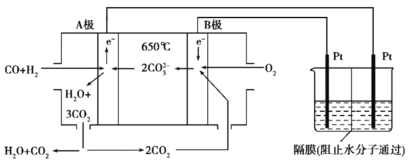
(1)H2(g)、CO(g)的燃烧热ΔH分别为-285.8kJ·mol-1、-283.0kJ·mol-1,1g液态水变为水蒸气时吸热2.44kJ,则电池总反应3CO(g)+H2(g)+2O2(g)=3CO2(g)+H2O(g)的ΔH=___________kJ·mol-1,B电极上发生反应的电极反应式为___________。
(2)若以此电源生产新型硝化剂N2O5,装置如上图所示。已知两室加入的试剂分别是a.硝酸溶液b.N2O4+无水硝酸,则左室加入的试剂应为___________(填“a”或“b”),其电极反应式为___________。
(3)若以此电源用惰性电极电解足量的硝酸银溶液,阴极产物的质量为5.4g,则阳极产生的气体在标准状况下的体积为___________L。电解后溶液体积为500mL,溶液的pH约为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() CH3COO-+H+,下列叙述正确的是( )
CH3COO-+H+,下列叙述正确的是( )
A.向溶液中加少量的CH3COONa固体或者降低温度,平衡均逆向移动,醋酸的电离常数Ka均减小
B.0.10mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)增大
C.0.10mol/LCH3COOH溶液比0.010mol/LCH3COOH溶液中c(H+)大10倍
D.室温下,欲使0.1mol/L醋酸溶液的pH、电离度α都减小,可加入少量水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示.下列说法错误的是( )
A.海水淡化常用的方法有蒸馏法、电渗析法和离子交换法等
B.工业生产过程中,海水提镁通常选用NaOH作为沉淀剂
C.向苦卤中通入![]() 是为了提取溴
是为了提取溴
D.富集溴一般先用空气和水蒸气吹出单质溴,再用![]() 将其还原吸收
将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)![]() 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如图所示。请回答下列问题:
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如图所示。请回答下列问题:
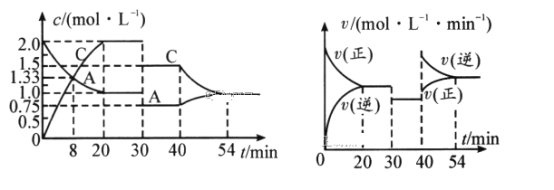
(1)0~20min,A的平均反应速率为__mol/(L·min);8min时,v正__v逆(填“>”“=”或“<”)。
(2)反应方程式中的x=__,30min时改变的反应条件是__。
(3)20~30min时反应的平衡常数__(填“>”“=”或“<”)3040min时反应的平衡常数。
(4)该反应的正反应为__(填“放热”或“吸热”)反应。
(5)反应过程中B的转化率最大的时间段是_min。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com