
芦笋中的天冬酰胺(结构如右图)和微量元素硒、铬锰等,具有提高身体免疫力的功效。
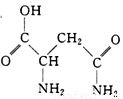
(1)天冬酰胺所含元素中, (填元素名称)元素基态原子核外未成对电子数最多。
(2)天冬酰胺中碳原子的杂化轨道类型有 种。
(3)H2S和H2Se的参数对比见下表。
化学式 | 键长/nm | 键角 | 沸点/℃ |
H2S | 1.34 | 92.3º | -60.75 |
H2Se | 1.47 | 91.0º | -41.50 |
①H2Se的晶体类型为 ,含有的共价键类型为 。
②H2S的键角大于H2Se的原因可能为 。
(4)已知铝(Mo)位于第五周期VIB族,钼、铬、锰的部分电离能如下表所示
编号 | I5/KJ·mol-1 | I6/KJ·mol-1 | I7/KJ·mol-1 | I8/KJ·mol-1 |
A | 6990 | 9220 | 11500 | 18770 |
B | 6702 | 8745 | 15455 | 17820 |
C | 5257 | 6641 | 12125 | 13860 |
A是 (填元素符号),B的价电子排布式为 。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年黑龙江、吉林两省八校高一上学期期中化学试卷(解析版) 题型:实验题
KC1样品中含有少量K2CO3、K2SO4和不溶于水的杂质,为了提纯KC1,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作:
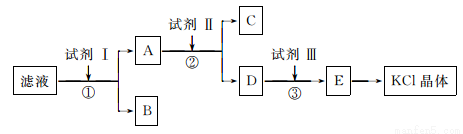
回答下列问题:
(1)为检验起始滤液中的Cl-,所用试剂除了稀硝酸,还需要_____________溶液。
(2)试剂I的化学式为________________,判断试剂I已加过量的方法是_____________。
(3)试剂Ⅱ的化学式为__________________,②中加入试剂Ⅱ的目的是__________________。
(4)试剂Ⅲ的名称是__________,③中发生反应的离子方程式为________________。
(5)某同学根据最终所得KC1晶体质量和原样品的质量计算出氯化钾样品的纯度,你认为结果可靠吗?并说明理由(不考虑实验误差):__________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一上期中化学卷(解析版) 题型:填空题
(1)14.2gC12含_________个氯气分子,_______摩尔氯原子,标准状况下所占的体积为________升,与这些Cl2分子数相同H2的质量是__________g,它们恰好完全反应后得到的氯化氢气体的物质的量是________摩尔,质量为________g,在标准状况下是_______升,将产生的氯化氢气体溶于490.4 mL水中,则所得溶液的质量为________g,若所得溶液的密度为1.01g/cm3,则该溶液的体积为_________ L。溶液的物质的量浓度为_________mol/L,质量分数为__________。
(2)在下列物质:① 烧碱②SO3 ③ 铁片④ 石墨⑤ 甲烷 ⑥醋酸 ⑦盐酸 ⑧硫酸钡,属于电解质的是__________(请填序号,下同),其中属于强电解质的是____________,属于非电解质的是__________,既不属于电解质又不属于非电解质的是____________。
(3)标准状况下,1 体积水能溶解448 体积HCl,所得溶液的密度为1.2g/mL,该溶液的质量分数和物质的量的浓度分别是____________、_____________。(保留1位小数)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一上期中化学卷(解析版) 题型:选择题
下列各组中的两物质作用时,反应条件或反应物用量的改变,对生成物没有影响的是( )
A.Na2O2和CO2 B.Na和O2 C.NaOH 和CO2 D.C和O2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一上期中化学卷(解析版) 题型:选择题
设NA代表阿佛加德罗常数,下列说法正确的是( )
A.22.4LCO和CO2的混合气体中所含的碳原子数一定是NA
B.含1molHCl的盐酸溶液与足量Fe反应,Fe所失去的电子总数为2NA
C.常温常压下,32gO2和32gO3所含氧原子数都是2NA
D.标准状况下,11.2LH2O含有0.5NA分子
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高二上期中化学卷(解析版) 题型:选择题
正硼酸(H3BO3)是一种层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图)。下列有关说法正确的是
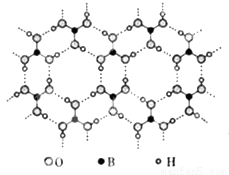
A.正硼酸晶体属于分子晶体
B.分子中硼原子最外层为8e-稳定结构
C.H3BO3分子的稳定性与氢键有关
D.含1mol H3BO3的晶体中有6mol氢键
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高二上期中化学卷(解析版) 题型:选择题
在半导体生产或灭火剂的使用中,会向空气中逸散气体,如:NF3、CHClFCF3、C3F8等。它们虽然是微量的,有些却是强温室气体。下列推测不正确的是
A.NF3分子呈三角锥形 B.C3F8在CCl4中溶解度比在水中的大
C.CHClFCF3存在手性异构 D.CHClFCF3中没有非极性键
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省赣州市十四校高二上学期期中化学试卷(解析版) 题型:填空题
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g)+2H2(g) CH3OH(g)ΔH
CH3OH(g)ΔH
(1)能判断反应达到平衡状态的依据是 (填字母序号)。
A.2V 逆(H 2) = V正(CO)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H 2的浓度都不再发生变化
E.容器内CO、H 2、CH3OH的浓度之比为1:2:1
F、CO、H2 、CH3OH的速率之比为1:2:1
(2)CO在不同温度下的平衡转化率与压强的关系如图1,该反应△H 0(填“>”或“<”)

(3)一定温度下,将4a mol H 2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则:
①该反应的平衡常数为 。
②若此时再向该容器中投入a mol CO、2amol H 2 和amol CH3OH,判断平衡移动的方向是 (“正向移动”“逆向移动”或“不移动”);
③在其他条件不变的情况下,将容器体积压缩到原来的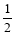 ,与原平衡相比
,与原平衡相比 ,下列有关说法正确的是 (填字母).
,下列有关说法正确的是 (填字母).
A.H2的浓 度减小;
度减小;
B.正反应速率加快,逆反应速率也加快;
C.甲醇的物质的量增加;
D.重新平衡时,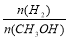 增大;
增大;
(4)上图2表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A C,由状态B到状态A,可采用 的方法(填“升温”或“降温”).
(5)甲醇燃料电池(电解质溶液为KOH溶液)结构示意图3,写出 a处电极上发生的电极反应式
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省辽源市高一上学期期中化学卷(解析版) 题型:选择题
相同温度和压强下,1 mol CO 和 1 mol CO2相比较,下列说法不正确的是
A.体积相同,但不一定是22.4L
B.分子数相同,但原子数不同
C.摩尔质量不同,氧原子个数相同
D.质子数不同,电子数也不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com