
| 操作 | 现象 | 解释或结论 | |
| A | 充分浸透了 Na2SiO3饱和溶液的小木条,沥干后放在酒精灯外焰加热 | 小木条不燃烧 | Na2SiO3可用作木材防火剂 |
| B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 溶液中有Na+、无K+ |
| C | 分别向含有酚酞的烧碱溶液中通入氯气、二氧化硫 | 溶液颜色都变淺 | 说明氯气和二氧化硫都有 漂白性 |
| D | 向某加碘食盐溶液中滴加淀粉溶液 | 溶液颜色不变 | 该食盐中一定没有添加 KIO3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.硅酸钠熔点高,可用作阻燃剂;
B.只能确定含有钠离子,无法确定是否含有钾离子;
C.二氧化硫与氢氧化钠溶液发生中和反应,二氧化硫不能漂白酸碱指示剂;氯气不具有漂白性;
D.碘单质与淀粉显示蓝色,该性质不是碘元素的性质.
解答 解:A.Na2SiO3熔点高,比较稳定,可用作木材防火剂,故A正确;
B.火焰呈黄色说明含有Na+,观察钾离子的火焰颜色需要通过蓝色钴玻璃,所以无法确定是否含有K+,故B错误;
C.向含有酚酞的烧碱溶液中通入氯气、二氧化硫,氯气不具有漂白性,氯气与水反应生成的次氯酸具有漂白性;二氧化硫与氢氧化钠溶液发生中和反应导致溶液褪色,二氧化硫表现了酸性,故C错误;
D.KIO3中含有的碘元素不能使淀粉变蓝,该操作方法不能检验食盐中是否添加KIO3,故D错误;
故选A.
点评 本题考查化学实验方案的评价,题目难度不大,涉及离子检验、物质漂白性、常见元素及其化合物性质等知识,明确常见元素及其化合物性质为解答关键,注意掌握常见离子的性质及检验方法,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
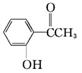 乙:
乙: ,丙:
,丙: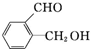
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
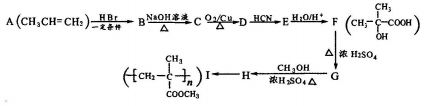
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 24gNaH中阴离子所含电子总数为2NA | |
| B. | 标准状况下,44.8LNO与22.4LO2混合后,气体中分子总数为2NA | |
| C. | 在0.lmol/L的K2CO3溶液中,阴离子数目大于O.1NA | |
| D. | 300mL2mol/L乙醇溶液中所含分子数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0g H218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下,30g丙醇中存在的共价键总数为5NA | |
| C. | 2 mol Cu和足量热浓硫酸反应可生成2NA个SO3分子 | |
| D. | 电解法精炼铜时,若转移的电子数为NA个,则阳极质量减小32g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碘化钠溶液中加入新制氯水可看到有紫黑色固体生成 | |
| B. | 向分别装有1gNa2CO3和NaHCO3固体的试管中滴入几滴水,温度高的为Na2CO3 | |
| C. | 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,变红,说明样品变质 | |
| D. | 中和热测定时环形玻璃搅拌棒要不断顺时针搅拌,目的是为了混合均匀,充分反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
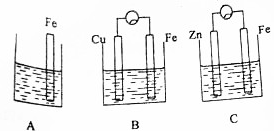 A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com