
【题目】实验室中某些气体的制取、收集及尾气处理装置如下图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | A中的物质 | B中的物质 | C中收集的气体 | D中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】邻苯二甲酸丁基月桂酯是一种淡黄色透明油状液体,密度约0.97g/cm3,常用作聚氯乙烯等树脂的增塑剂。工业上生产原理和工艺流程如下:
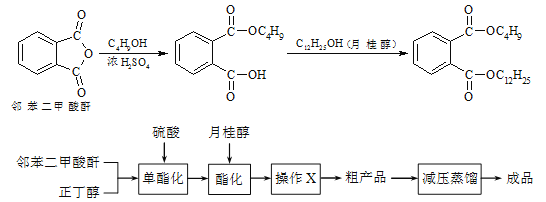
有关物质的物理性质见下表:
化合物 | 溶解性 | 熔点 | 沸点 |
邻苯二甲酸酐 | 微溶于冷水、乙醚,易溶于热苯、乙醇、乙酸 | 131.6℃ | 295℃ |
正丁醇 | 微溶于水,溶于乙醇、醚、多数有机溶剂 | -88.9℃ | 117.5℃ |
月桂醇 | 不溶于水,溶于醇、醚 | 24 | 259℃ |
邻苯二甲酸丁基月桂酯 | 不溶于水,溶于多数有机溶剂 | 不祥 | 202~210℃ |
某实验小组的同学模拟工业生产的工艺流程,用右图所示装置制取少量邻苯二甲酸丁基月桂酯,图中夹持和加热装置已略去。主要操作步骤如下:
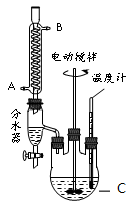
①向三颈烧瓶内加入30 g 邻苯二甲酸酐、16 g 正丁醇以及少量浓硫酸。
②搅拌,升温至105 ℃,持续搅拌反应1小时。
③冷却至室温,加入40 g 月桂醇,升温至160 ℃,搅拌、保温至反应结束。
④冷却至室温,将反应混合物倒出。
⑤通过工艺流程中的操作X,得到粗产品。
请回答下列问题:
(1)仪器C的名称___________。冷凝管中冷水应从___________进。
(2)步骤③中判断反应已结束的方法是___________。
(3)步骤⑤中操作X可除去少量未反应的邻苯二甲酸酐及正丁醇,操作X包括___________。
(4)工艺流程中减压蒸馏的目的是___________。
(5)实验结果表明步骤②、③产率都比较高,原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大。A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,D元素的价电子数是其余电子数的一半,C与B同主族,A与F同主族,D与E同族。回答下列问题:
(1)A、B、C第一电离能由大到小的顺序为: (用元素符号表示)。
(2)B与C形成的二元化合物中,属于非极性分子的是: (填化学式);该分子中心原子的杂化类型为: 。
(3)A、C元素形成的常见含氧酸中,分子的中心原子的价层电子对数为4的酸是 ;(填化学式,下同)酸根呈平面三角形的酸是 。
(4)E和F形成的一种化合物的晶体结构如图所示,则该化合物的化学式为 ;F的配位数为 。
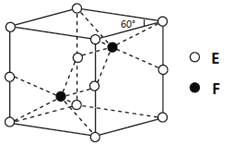
(5)D的离子可以形成多种配合物,由Dn+、Br-、C的
最高价含氧酸根和A的简单氢化物形成的1:1:1:5的某
配合物,向该配合物的溶液中滴加AgNO3溶液产生
淡黄色沉淀,滴加BaCl2溶液无现象,则该配合物的化学式为: ;n值为 ;Dn+的基态电子排布式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用简易装置模拟演示工业炼铁原理,实验装置图和实验步骤如下:
![]()
![]()
![]()
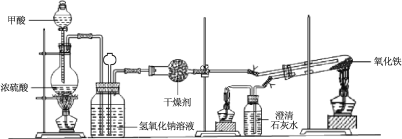
① 按上图连接好装置,检查装置气密性。
② 称取适量 Fe2O3于石英试管中,点燃Ⅰ处酒精灯,缓慢滴入甲酸。
③ 在完成某项操作后,点燃另外两处酒精灯。
④ 30 min后熄灭酒精灯,关闭弹簧夹。
⑤ 待产物冷却至室温后,收集产物。
⑥ 采用如上方法分别收集带金属网罩酒精灯(金属网罩可以集中火焰、提高温度)和酒精喷灯加热的产物。
请回答下列问题:
(1)制备CO的原理是利用甲酸(HCOOH)在浓硫酸加热条件下的分解制得,盛放甲酸的仪器名称为 ,该反应的化学方程式 。
(2)实验步骤③某项操作是指 。
(3)实验步骤④熄灭酒精灯的顺序为______________。(填I,II,III)
(4)通过查资料获取如下信息:
I.酒精灯平均温度为600℃;加网罩酒精灯平均温度为700℃,酒精喷灯平均温度为930℃。
II.资料指出当反应温度高于710℃,Fe能稳定存在,680℃~710℃之间,FeO稳定存在,低于680℃,则主要是Fe3O4。试分析酒精灯加热条件下生成Fe的原因是 。
(5)已知FeO、Fe2O3、Fe3O4氧元素的质量分数分别为:22.2%、30%、27.6%。利用仪器分析测出3种样品所含元素种类和各元素的质量分数如下表:
加热方式 | 产物元素组成 | 各元素的质量分数%[§科§网] | |
Fe | O | ||
酒精灯 | Fe和O | 74.50 | 25.50 |
带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
酒精喷灯 | Fe | 100.00 | 0.00 |
分析各元素的质量分数可知前二种加热方式得到的产物为混合物,其中酒精灯加热所得产物的组成最多有_______种可能。
(6)通过进一步的仪器分析测出前二种加热方式得到的固体粉末成分均为Fe3O4和Fe,用酒精喷灯加热得到的固体粉末成分为Fe。请计算利用酒精灯加热方式混合物中Fe3O4和Fe的质量比为_____。(要求保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A~J分别代表相关反应的一种物质。已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出。请填写以下空白:

(1)A中含有的化学键是________。
(2)写出铜与J反应制取H的化学方程式:__________________________________________。
(3)写出反应③的离子方程式:_________________________________________。
(4)写出物质B的电子式:_______________;写出物质E的电子式:_______________。
(5)在反应④中,当生成标况下22.4 L 物质G时,转移电子数为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修2化学与技术】
铁在自然界分布广泛,在工业、农业和国防科技中有重要应用。
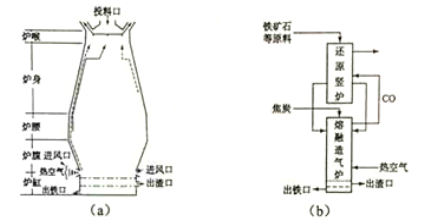
回答下列问题:
(1)用铁矿石(赤铁矿)冶炼生铁的高炉如图(a)所示。原料中除铁矿石和焦炭外含有 。除去铁矿石中脉石(主要成分为SiO2 )的化学反应方程式为 、 ;高炉排出气体的主要成分有N2、CO2 和 (填化学式)。
(2)已知:①Fe2O3 (s)+3C(s)=2Fe(s)+3CO(g) ΔH=+494kJ·mol-1
②CO(g)+O2(g)=CO2(g) ΔH=-283kJ·mol-1
③C(s)+O2(g)=CO(g) ΔH=-110kJ·mol-1
则反应Fe2O3 (s)+3 C(s)+ O2(g)=2Fe(s)+3CO2 (g) 的ΔH= kJ·mol-1。理论上反应 放出的热量足以供给反应 所需的热量(填上述方程式序号)
(3)有人设计出“二步熔融还原法”炼铁工艺,其流程如图(b)所示,其中,还原竖炉相当于高炉的
部分,主要反应的化学方程式为 ;熔融造气炉相当于高炉的 部分。
(4)铁矿石中常含有硫,使高炉气中混有SO2 污染空气,脱SO2 的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学–选修2:化学与技术】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
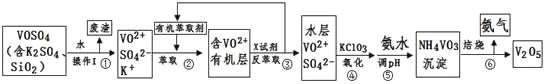
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+2nHA(有机层)![]() 2RAn(有机层)+nH2SO4 (水层)
2RAn(有机层)+nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)④的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 。
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有 和 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香烃A有如下转化关系:
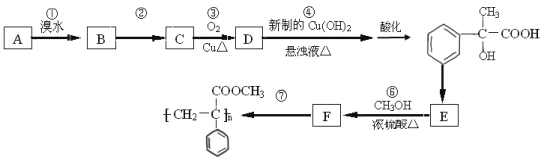
(1)写出反应②和⑤的反应条件:② ;⑤ .
(2)写出A的结构简式: ;
(3)写出反应④的化学方程式: .
(4)反应③的反应类型 .
(5)根据已学知识和获取的信息,写出以CH3COOH,![]() 为原料合成重要的化工产品
为原料合成重要的化工产品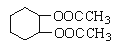 的路线流程图(无机试剂任选)
的路线流程图(无机试剂任选)
合成路线流程图示例如下:
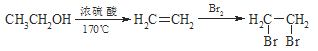
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH=2K2CO3+6H2O
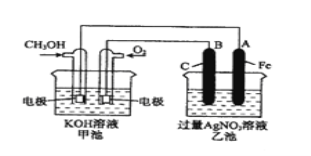
(1)请回答图中甲、乙两池的名称。甲电池是 装置,乙池是 装置。
(2)请回答下列电极的名称:通入CH3OH的电极名称是 ,B(石墨)电极的名称是 。
(3)写出电极反应式:
通入O2的电极的电极反应式是 。
A(Fe)电极的电极反应式为 。
(4)乙池中反应的化学方程式为 。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标况)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com