
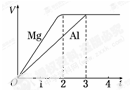
 一定质量的镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.下列关于反应的说法错误的是( )
一定质量的镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.下列关于反应的说法错误的是( )| A. | 镁和铝的物质的量之比为3:2 | B. | 镁和铝转移电子数之比为1:3 | ||
| C. | 镁和铝的摩尔质量之比为8:9 | D. | 镁和铝反应所用时间之比为2:3 |
分析 A.镁和铝分别与等浓度、等体积的过量稀硫酸反应,则金属完全反应,最终生成氢气体积相同,金属提供电子相等,根据电子转移守恒计算二者物质的量之比;
B.最终生成氢气体积相同,金属提供电子相等;
C.摩尔质量以g/mol为单位,数值上等于其相对原子质量;
D.根据图象可知生成相同体积的氢气所用时间.
解答 解:A.生成氢气相等,金属提供电子相等,则2n(Mg)=3n(Al),故n(Mg):n(Al)=3:2,故A正确;
B.生成氢气相等,金属提供电子相等,故镁和铝转移电子数之比为1:1,故B错误;
C.镁和铝的摩尔质量之比为24g/mol:27g/mol=8:9,故C正确;
D.根据图象可知,镁和铝反应所用时间之比为2:3,故D正确,
故选:B.
点评 本题以图象形式考查化学方程式计算,注意利用守恒进行解答,较好的考查学生读图能力、分析计算能力,难度不大.


科目:高中化学 来源: 题型:解答题
 、
、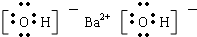 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漏斗 | B. | 玻璃棒 | C. | 烧杯 | D. | 容量瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8g O2的体积为5.6L | |
| B. | 标准状况下,22.4 L H2O所含的分子数为NA | |
| C. | 标准状况下,50mL 0.2mol•L-1的盐酸中含有分子数为0.01NA | |
| D. | 常温常压下,10g氖气含有的原子数为0.5NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
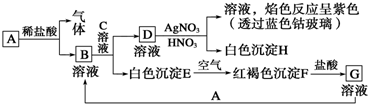
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | amol | 0 | 0 |
| A. | 当通入Cl2的体积为2.8L时,只有I-与Cl2发生反应 | |
| B. | 当通入Cl2的体积为2.8-5.6L时,只有Br-与Cl2发生反应 | |
| C. | a=0.15 | |
| D. | 原溶液中c(Cl-):c(Br-):c(I-)=10:15:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | |
| Z | W |
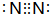 ;Y和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;
;Y和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com