
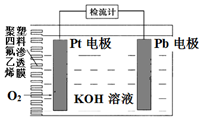
 电池式氧传感器原理构造如图,可测定O2的含量.工作时铅极表面会逐渐附着Pb(OH)2.下列说法不正确的是( )
电池式氧传感器原理构造如图,可测定O2的含量.工作时铅极表面会逐渐附着Pb(OH)2.下列说法不正确的是( )| A. | Pt电极上发生还原反应 | |
| B. | 随着使用,电解液的pH逐渐减小 | |
| C. | a mmolO2反应,理论上可使Pb电极增重68a mg | |
| D. | Pb电极上的反应式为Pb+2OH--2e-=Pb(OH)2 |
分析 原电池工作时,铅失电子在负极发生氧化反应生成Pb(OH)2,电极反应式为Pb+2OH--2e-=Pb(OH)2,O2在正极Pt上得电子生成OH-,电极反应式为O2+2H2O+4e-=4OH-,以此解答该题.
解答 解:A.Pt电极上O2得电子生成OH-,发生还原反应,故A正确;
B.铅失电子在负极发生氧化反应生成Pb(OH)2,电极反应式为Pb+2OH--2e-=Pb(OH)2,O2在正极Pt上得电子生成OH-,电极反应式为O2+2H2O+4e-=4OH-,总反应为:2Pb+O2+2H2O=2Pb(OH)2,消耗水,电解液碱性增强,所以电解液的pH逐渐增大,故B错误;
C.a mmolO2反应则得到4a mmol电子,所以根据得失电子守恒,理论上可使Pb电极增重4a mmol×17g/mol=68a mg,故C正确;
D.铅失电子在负极发生氧化反应生成Pb(OH)2,电极反应式为Pb+2OH--2e-=Pb(OH)2,故D正确;
故选B.
点评 本题考查了原电池原理,明确电池中物质得失电子即可解答,难点是电极反应式书写,要根据电解质确定正负极产物,难度中等.


科目:高中化学 来源: 题型:解答题
 SiCl4在室温下为无色液体,易挥发,有强烈的刺激性气味.工业上,提纯粗硅的原理如下:粗硅$→_{△}^{HCl}$SiCl4$→_{△}^{Si+H_{2}}$SiHCl3$→_{△}^{H_{2}}$Si(纯)
SiCl4在室温下为无色液体,易挥发,有强烈的刺激性气味.工业上,提纯粗硅的原理如下:粗硅$→_{△}^{HCl}$SiCl4$→_{△}^{Si+H_{2}}$SiHCl3$→_{△}^{H_{2}}$Si(纯)查看答案和解析>>
科目:高中化学 来源: 题型:多选题
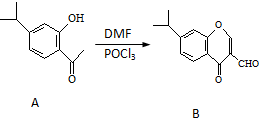 有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )
有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )| A. | 分子A中至少有8个碳原子位于同一平面 | |
| B. | 1molA与浓溴水发生取代反应时,最多消耗3molBr2 | |
| C. | 物质B既能发生银镜反应,又能发生水解反应 | |
| D. | 1mol B最多可与6mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
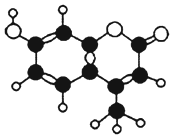 可调谐激光器所用的某种染料由C、H、O三种元素组成,分子球棍模型如图所示,下列关于该染料的叙述正确的是( )
可调谐激光器所用的某种染料由C、H、O三种元素组成,分子球棍模型如图所示,下列关于该染料的叙述正确的是( )| A. | ①③⑤ | B. | ③④⑤ | C. | ③④⑤⑥ | D. | ②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气通入醋酸溶液中:CH3COOH+NH3═CH3COO-+NH4+ | |
| B. | 向苯酚纳溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| C. | 等物质的量Cl2与FeBr2在溶液反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 惰性电极电解硫酸铜溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “神州七号”的防护层中含聚四氟乙烯,制备聚四氟乙烯的单体属于不饱和烃 | |
| B. | 聚乳酸是常用的微生物降解高分子:合成纤维、人造纤维统称化学纤维 | |
| C. | 铁是生活中常用的金属,在一些反应中可作催化剂 | |
| D. | 回收地沟油制造生物柴油符合环境保护的要求 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com