A
分析:A、先计算一个臭氧分子中含有的氧原子数,再计算48gO
3含有的氧原子数;
B、先计算一个铵根离子中含有的电子数,再计算1.8g的NH
4+离子中含有的电子数;
C、气体摩尔体积22.4L/mol的使用条件是标况;
D、根据n=cV判断.
解答:A、一个臭氧分子中含有3个氧原子,48gO
3中含有的氧原子的个数为N(0)=3n(O
3)N
A=3
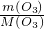
N
A=3

N
A=3N
A,故A正确;
B、一个铵根离子中含有的电子数为10,1.8g的NH
4+离子中含有的电子数为N(电子)=10n(NH
4+)N
A=10
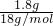
N
A=N
A,故B错误;
C、气体摩尔体积22.4L/mol的使用条件是标况,常温常压的气体摩尔体积未知,使用无法计算氧气含有的原子数,故C错误;
D、溶液的体积未知,所以无法计算含有的氯离子数,故D错误;
故选A.
点评:本题考查了阿伏伽德罗常数的有关计算,难度不大,注意气体摩尔体积的使用范围和条件.

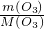 NA=3
NA=3 NA=3NA,故A正确;
NA=3NA,故A正确;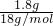 NA=NA,故B错误;
NA=NA,故B错误;
