
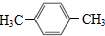
 ,下列关于PX的说法正确的是( )
,下列关于PX的说法正确的是( )| A. | 属于饱和烃 | B. | 其一氯代物有四种 | ||
| C. | 可用于生产对苯二甲酸 | D. | 分子中所有原子都处于同一平面 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.5mol | B. | 2.1mol | C. | 2.4 mol | D. | 3.0 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| B. | 0.5mol C3H8分子中所含C-H共价键数为2NA | |
| C. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| D. | 1mol碳正离子CH5+所含的电子数为11NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为除去FeCl2溶液中少量的FeCl3,可加入过量铁粉,再过滤 | |
| B. | 明矾中Al3+水解产生具有吸附性的胶体,明矾可用于自来水的净化 | |
| C. | 为除去CO2中少量的HCl,可使其通过饱和的Na2CO3溶液 | |
| D. | 为除去KCl溶液中少量的MgCl2,可加入适量KOH溶液,再过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离的c(H+):①=②=③=④ | |
| B. | 将②、③溶液混合后pH=7,则消耗溶液的体积:②>③ | |
| C. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最小 | |
| D. | 向溶液中加水稀释到原来的10倍,溶液的pH:④>③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的NaClO溶液中含ClO-的浓度小于0.1mol/L | |
| B. | 标准状况下,22.4L乙烯中含极性共价键数为4NA | |
| C. | 1 mol氢氧根离子与1mol羟基所含电子数均为10NA | |
| D. | 3.0g甲醛和甲酸甲酯的混合物中含有的原子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,负极质量增加 | |
| B. | 放电时,溶液中的BF4-只向正极移动 | |
| C. | 充电时,阳极附近溶液的酸性增强 | |
| D. | 充电时,阴极的电极反应式为Pb2+-2e-=Pb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应物 | 反应条件1 | 反应条件2 | |
| A | CH3CHICH3 | NaOH的水溶液,加热 | NaOH的乙醇溶液,加热 |
| B | 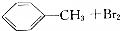 | 光照 | 铁粉 |
| C | 乙醇+氧 | 点燃 | Cu做催化剂,加热 |
| D | 乙烯 | 溴水 | 溴的四氯化碳溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com