
| 编号 | 1 | 2 | 3 | 4 |
| Na2S2O3溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 20.01 | 20.02 |
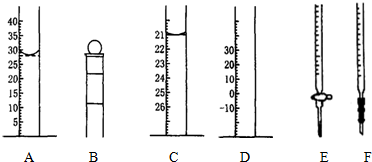
分析 (1)A为量筒,根据量筒的构造及液面的凹液面物质读出溶液体积;
(2)根据仪器B的构造写出其名称;
(3)S2O32?离子在溶液中水解导致溶液显示碱性;
①配制判断浓度的溶液需要使用容量瓶,B为容量瓶;
②Na2S2O3溶液显示碱性,需要使用碱式滴定管盛放;
③根据反应结束前溶液为无色、滴定结束时溶液显示蓝色判断滴定终点;
④先根据滴定消耗的标准液的体积计算出平均体积,然后根据反应2S2O32-+I2═S4O62-+2I-计算出10mL待测液中Na2S2O3溶液的物质的量及浓度;
⑤锥形瓶不能润洗,若用Na2S2O3溶液润洗锥形瓶,会导致测定的待测液浓度偏高,测定结果偏高;
解答 解:(1)A为量筒,图中液面所示溶液的体积为28.0mL,
故答案为:28.0;
(2)仪器B下面带有玻璃旋塞,所以仪器B为酸式滴定管,
故答案为:酸式滴定管;
(3)S2O32?离子水解:S2O32?+5H2O?HS2O3?+0H?,导致溶液显示碱性,
故答案为:S2O32?+5H2O?HS2O3?+0H?;
①配制一定物质的量浓度的溶液,需要使用容量瓶进行配制,B为容量瓶,
故答案为:B;
②Na2S2O3溶液显示碱性,需要使用碱式滴定管量取,E为酸式滴定管、F为碱式滴定管,所以应该使用F量取,
故答案为:F;
③用浓度为0.0500mol/L的I2标准溶液进行滴定,滴定结束前碘单质没有剩余,溶液为无色,滴定结束时碘单质过量,溶液变成蓝色,则滴定终点的现象为:锥形瓶中的溶液由无色溶液变成蓝色,且半分钟不褪色,
故答案为:锥形瓶中的溶液由无色溶液变成蓝色,且半分钟不褪色;
④滴定过程中消耗I2标准溶液的平均体积为:01$\frac{19.99+19.98+20.01+20.02}{4}$mL=20.00mL,10mL待测液消耗的碘单质的物质的量为:n(I2)=0.0500mol/L×0.02L=0.001mol,根据反应2S2O32-+I2═S4O62-+2I-可知,10mL待测液中含有的硫代硫酸钠的物质的量为:n(S2O32-)=2n(I2)=0.002mol,待测液的浓度为:c=$\frac{0.002mol}{0.10L}$=0.2000mol/L;
故答案为:0.2000;
⑤滴定时若用Na2S2O3溶液润洗锥形瓶,滴定时消耗的标准液体积偏大,测定的待测液浓度偏高,计算出的硫代硫酸钠晶体的质量偏大,则测得大苏打产品的纯度偏高;
故答案为:偏高;
点评 本题考查了中和滴定操作方法及计算、计量仪器的构造及使用方法,题目难度中等,试题涉及的题量较大,注意掌握中和滴定操作方法,能够根据指示剂特点及反应原理正确判断滴定终点.


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 22.4L氯气与足量的铜充分反应 | B. | 0.2mol浓硫酸与足量铜反应 | ||
| C. | 46g金属钠与足量的水反应 | D. | 56g铁与足量稀硝酸溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将实验完剩余的金属钠放回原试剂瓶中 | |
| B. | 测定熔融氢氧化钠的导电性,可在铁质坩埚中熔化氢氧化钠固体后进行测量 | |
| C. | 制备Fe(OH)3胶体通常是将饱和氯化铁溶液煮沸,直至呈红褐色时停止加热 | |
| D. | 在饱和NaOH溶液中加一定量Na2O2,充分反应后恢复到原温度,有晶体析出,溶液质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘是人体必需微量元素,所以应多吃富含高碘酸的食物 | |
| B. | “血液透析”运用了胶体的性质 | |
| C. | 过氧化钠可作为高空飞行或潜水装置中的供氧剂 | |
| D. | 大力开发太阳能、风能、水能等新能源,减少煤、石油等化石燃料的使用,有利于实现“低碳经济” |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | ① | |||||||
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑨ | |||||||
| 5 | ⑩ |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com