
分析 根据n=$\frac{m}{M}$计算4.35g MnO2的物质的量,根据方程式计算生成氯气物质的量,再根据V=nVm计算氯气体积;剩余的盐酸用NaOH中和,反应生成NaCl,则反应后溶液中n(Cl-)=2n(MnCl2)+n(NaCl)=2n(MnCl2)+n(NaOH),进而计算溶液中氯离子物质的量,根据Ag++Cl-=AgCl↓计算生成AgCl沉淀的质量.
解答 解:8.7g MnO2的物质的量为$\frac{4.35g}{87g/mol}$=0.05mol,
设生成氯气物质的量为x,则:
4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
1mol 1mol
0.05mol x
故x=0.05mol
则生成氯气体积为0.05mol×22.4L/mol=1.12L;剩余的盐酸用NaOH中和,反应生成NaCl,则反应后溶液中n(Cl-)=2n(MnCl2)+n(NaCl)=2n(MnCl2)+n(NaOH)=0.05mol×2+0.1L×1mol/L=0.2mol,根据Ag++Cl-=AgCl↓可知生成AgCl沉淀的质量0.2mol×143.5g/mol=28.7g,
答:用4.35gMnO2与过量浓盐酸加热反应后生成标准状况下的Cl21.12L,可生成AgCl沉淀28.7g.
点评 本题考查化学方程式有关计算,难度不大,计算硝酸银体积时学生容易忽略氯化锰,只根据氯化钠计算,导致错误答案比较基础,旨在考查学生对基础知识的理解掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
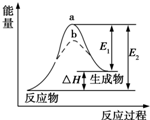
| A. | 如图可知a一定使用了催化剂 | |
| B. | 该反应为放热反应,△H=E1-E2 | |
| C. | 使用催化剂,可以改变化学平衡常数 | |
| D. | 使用催化剂,可降低该反应的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水可制得金属钠 | |
| B. | 工业上用焦炭在高温下还原二氧化硅可制得粗硅 | |
| C. | 高炉炼铁的主要反应是高温下焦炭和氧化铁直接作用炼出铁 | |
| D. | 不通过化学变化就可以从海水中提取溴单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+和Al(OH)3 | B. | Al(OH)3 | C. | Al(OH)3和AlO2 | D. | AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 科学家研究发现金属离子吸收氧气的能力十分巨大,人体血液中的血红蛋白依靠亚铁离子结合氧气,其他金属离子(Cu2+、Zn2+等)也可以实现结合和运输氧气的目的.最近丹麦科学家研发了一种晶体材料,该晶体吸收氧气的能力依靠钴离子,它可以让人在水下持久地获得氧气.
科学家研究发现金属离子吸收氧气的能力十分巨大,人体血液中的血红蛋白依靠亚铁离子结合氧气,其他金属离子(Cu2+、Zn2+等)也可以实现结合和运输氧气的目的.最近丹麦科学家研发了一种晶体材料,该晶体吸收氧气的能力依靠钴离子,它可以让人在水下持久地获得氧气.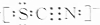 ,则SCN-中σ 键与π键的个数比为1:1.
,则SCN-中σ 键与π键的个数比为1:1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎打翻燃着的酒精灯,立即用湿抹布盖灭 | |
| B. | 金属钠着火时,立即用泡沫灭火器进行灭火 | |
| C. | 给盛有液体的试管加热时,要不断移动试管或加人碎瓷片 | |
| D. | 浓碱液滴在皮肤上,立即用大量水冲洗,然后涂上硼酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤、石油、天然气是不可再生能源,风能、生物质能、沼气是可再生能源 | |
| B. | “84消毒液”具有强氧化性,可做环境的消毒剂从而预防流感 | |
| C. | 已知水热反应是指在高温高压下,将二氧化碳转化为有机物的技术,则水热反应可以降低自然界中碳的含量 | |
| D. | 已知PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物”,则PM2.5在空气中有可能形成胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
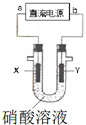 某兴趣小组为了分析电解硝酸溶液时放电的离子,设计了如图装置进行实验(石墨电极).电解过程中,X极产生了红棕色气体,则下列说法不合理的是( )
某兴趣小组为了分析电解硝酸溶液时放电的离子,设计了如图装置进行实验(石墨电极).电解过程中,X极产生了红棕色气体,则下列说法不合理的是( )| A. | a极为负极,b极为正极 | |
| B. | 电解时,Y极附近溶液pH降低 | |
| C. | 相同条件下,阴阳两极气体体积比是2:1 | |
| D. | X极的电极反应式是:2H++NO3-+e-═NO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液的pH值不变 | B. | 溶液中Na2CO3的物质的量不变 | ||
| C. | Na+与CO32-数目不变 | D. | Na2CO3溶液的浓度不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com