
分析 (1)根据质子数相同,中子数不同的原子互称同位素,研究对象为原子;
(2)由同种元素形成的不同种单质互为同素异形体,互为同素异形体的物质要符合以下两个条件:同种元素形成,不同单质;
(3)同系物指结构相似、通式相同,组成上相差1个或者若干个CH2原子团,具有相同官能团的化合物;
(4)同分异构体是指分子式相同,但结构不同的化合物;
(5)根据物质的俗名、名称或化学式或主要成分分析判断,主要成分属于同一种物质要求其化学名称相同,化学式相同.
解答 解:①16O2和18O3 是由氧元素组成的不同单质,属于同素异形体;
②金刚石和“足球烯”(C60)是由碳元素组成的不同单质,属于同素异形体;
③14C和12C质子数相同为6,中子数不同分别为7、6,是碳元素不同核素,互为同位素;
④40K40Ca仅质量数相同,其它什么都不是;
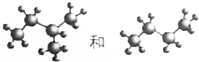
⑤CH3CH2CH2CH(C2H5)CH3和CH3CH2CH2CH(CH3)C2H5都为庚烷,为同一物质;
⑥环丙烷和丙烯,分子式相同,但它们的结构不同、所以二者互为同分异构体;
⑦乙烯和1,3-丁二烯,同属于烯烃,但不是同系物,因前者为单烯烃,后者为二烯烃;
⑧前者为2-甲基丁烷,后者为正丁烷,它们的结构相似、通式相同,组成上相差1个CH2,所以二者互为同系物;
故答案为:③;①②;⑧;⑥;⑤.
点评 本题考查了有机物的同系物、同素异形体、同分异构体、同位素、同种物质的判断,注意掌握常见有机物的命名方法,明确“五同”的概念及判断方法,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;V的氢氧化物作弱酸时有类似TR4-的离子产生,其电离方程式为Al(OH)3+H2O?H++[Al(OH)4]-.
;V的氢氧化物作弱酸时有类似TR4-的离子产生,其电离方程式为Al(OH)3+H2O?H++[Al(OH)4]-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙苯和环己烯都能使酸性高锰酸钾溶液褪色 | |
| B. | 糖、油脂、蛋白质都能发生水解反应 | |
| C. | 甲醛和乙二醇都可作为合成高分子化合物的单体 | |
| D. | 丙烷和2-甲基丙烷的一氯代物均为两种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
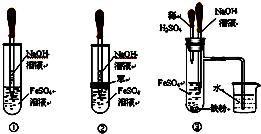
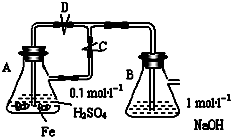
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清的石灰水与稀盐酸反应Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 氧化铜溶于硫酸:O2-+2H+═H2O | |
| D. | 碳酸钙溶于醋酸CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com