
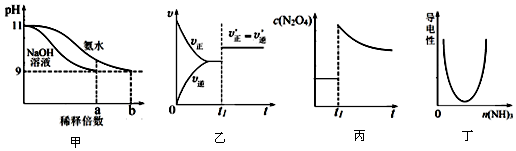
| A. | 图甲表示分别稀释pH=11的NaOH溶液和氨水时溶液pH的变化,图中b>a=100 | |
| B. | 图乙表示某化学平衡的移动,在t1时改变的条件一定是加入催化剂 | |
| C. | 图丙表示平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 | |
| D. | 图丁表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化 |
分析 A.一水合氨为弱电解质,不能完全电离;
B.如反应前后气体的体积不变,也可能为增大压强;
C.平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小,t1后c(N2O4)增大;
D.CH3COOH溶液中通入NH3,导电性逐渐增强.
解答 解:A.一水合氨为弱电解质,不能完全电离,pH由11变为9,氢氧化钠需稀释100倍,氨水的体积大于100倍,故A正确;
B.如反应前后气体的体积不变,也可能为增大压强,故B错误;
C.平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小,增大压强平衡正向移动,t1后c(N2O4)增大,故C错误;
D.CH3COOH溶液中通入NH3,生成醋酸铵为强电解质,则导电性逐渐增强,故D错误.
故选A.
点评 本题考查较为综合,涉及化学平衡的影响、弱电解质的电离等知识点,侧重考查学生的分析能力,明确这些反应原理是解本题关键,再结合曲线变化趋势及纵横坐标的含义来分析解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 铝盐和铁盐都可用作净水剂 | |
| B. | NH4Cl和ZnCl2溶液可用作焊接时的除锈剂 | |
| C. | 用牺牲镁块的方法防止地下钢铁管道的腐蚀 | |
| D. | 电解熔融氧化镁可以得到镁,电解熔融氯化镁不能得到镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
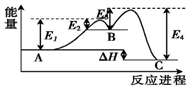 某反应由两步反应A→B→C构成,它的反应能量曲线如图(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A→B→C构成,它的反应能量曲线如图(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )| A. | A→B为吸热反应,B→C为放热反应 | B. | 三种化合物中B最稳定 | ||
| C. | 加入催化剂会改变反应的焓变 | D. | 整个反应的△H=E1-E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L NO与11.2L O2混合充分反应,产物的分子数为NA | |
| B. | 14g乙烯和丙烯混合气体中含有C-H共价键的数目为2NA | |
| C. | l mol Cu与足量的硫充分反应,电子转移数为2NA | |
| D. | 100mL l mol•L-1KClO溶液中,阴离子的数目小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 向一容积为5L的恒容密闭容器内,充入0.2mol CO和0.4mol H2O,在一定条件下发生反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H>0.反应中CO2的浓度(c) 随时间(t)的变化关系如图所示.
向一容积为5L的恒容密闭容器内,充入0.2mol CO和0.4mol H2O,在一定条件下发生反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H>0.反应中CO2的浓度(c) 随时间(t)的变化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4 L CO2含有的分子数为NA | |
| B. | 1mol•L-1的Ba(OH)2溶液中含有的氢氧根离子数目为2NA | |
| C. | 常温常压下,18 g H2O含有的氢原子数为2NA | |
| D. | 1mol Fe在足量的Cl2中充分燃烧,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释Na2CO3溶液时,$\frac{c(HC{{O}_{3}}^{-}•c(O{H}^{-}))}{c(C{{O}_{3}}^{2-})}$增大 | |
| B. | 常温下,反应4Fe(OH)2(s)+2H2O(I)+O2(g)═4Fe(OH)3(s)的△H<0,△S<0 | |
| C. | 用0.1mol•L-1CH3COOH溶液滴定0.1mol•L-1 NaOH至中性时:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| D. | 向纯水中加入盐酸或氢氧化钠都能使水的电离平衡逆向移动,水的离子积减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若将等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 相同条件下,1mol H2O(l)完全分解吸收的热量与H2、O2化合生成1mol H2O(l)放出的热量值不相等 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ | |
| D. | 在101KPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=+285.8kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com