
现有m g某气体,它由四原子分子构成,它的摩尔质量为M g•mol﹣1,则:
(1)该气体的物质的量为 mol.
(2)该气体中所含的原子总数为 个.
(3)该气体在标准状况下的体积为 L.
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为 .
(5)该气体溶于水后形成V L溶液,其溶液的物质的量浓度为 mol•L﹣1.
| 物质的量的相关计算;物质的量浓度的相关计算;有关反应热的计算.. | |
| 专题: | 计算题. |
| 分析: | (1)利用n= (2)利用气体的物质的量及它由四原子分子构成来分析原子数; (3)利用V=n×Vm及标准状况下来计算其体积; (4)根据公式:质量分数=m(溶质质量)÷m(溶液质量)×100%来计算; (5)根据c=n/v来计算; |
| 解答: | 解:(1)根据公式n= (2)根据公式得气体分子的物质的量n= (3)根据公式V=nVm得V= (4)根据公式质量分数=m(溶质质量)÷m(溶液质量)×100%,得溶液中溶质的质量分数为 (5)根据公式c= 故答案为:(1) |
| 点评: | 本题主要考查学生对物质的量所涉及的公式的理解和灵活运用,明确质量、体积、粒子数目、浓度、物质的量的关系即可解答,并注意摩尔质量的意义来计算,题目的综合性较强,有一定的难度. |


科目:高中化学 来源: 题型:
下列各组溶液中,各离子一定能大量共存的是 A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、I-
B.pH为1的溶液:Cu2+、Na+、NO-3、SO42-
C.水电离出来的c(H+)=10-13mol/L的溶液:K+、Ba2+、HCO3-、Br-
D.溶质为Na2SO4的溶液:K+、Al3+、CO32-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
在Al2(SO4)3和MgSO4组成的混合物中,Al3 +与Mg2+的物质的量之比为2
+与Mg2+的物质的量之比为2 ∶3,则在含有2 mol SO
∶3,则在含有2 mol SO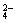 的混合物中,MgSO4的质量是多少克?
的混合物中,MgSO4的质量是多少克?
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | 氢氧化钠的摩尔质量是40g |
|
| B. | 1molNaOH的质量是40g/mol |
|
| C. | 1gH2和1gN2所含分子数相等 |
|
| D. | 阿伏伽德罗常数个钠原子的质量是23g |
查看答案和解析>>
科目:高中化学 来源: 题型:
混合气体由O2和CH4组成,测得混合气体在标准状况下的密度为1.25g/L,则混合气体中O2和CH4的体积之比为( )
|
| A. | 3:1 | B. | 1:3 | C. | 4:1 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A、利用醋酸溶解含碳酸钙的水垢:CaCO3+2H+===Ca2++H2O+CO2↑
B、用铜为电极电解饱和食盐水:2Cl-+2H2O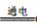 Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C、在明矾溶液中滴加过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
D、在小苏打溶液中加少量 Ba(OH)2 溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的 pH 在 5.0~6.0 之间,通过电解生成 Fe(OH)3 沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成 浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置如图所示: (1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,则无法使悬浮物形成浮渣。
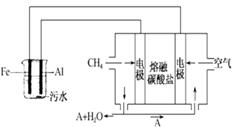

此时,应向污水中加入适量的_________。
a. H2SO4 b.BaSO4 c.Na2SO4 d.NaOH e.CH3CH2OH
(2)电解池阳极的电极反应分别是①______________;
②4OH--4e-=2H2O+O2↑
(3)电极反应①和②的生成物反应得到 Fe(OH)3 沉淀的离子方程式是__________。
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以 CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是 CH4+4CO2-8e-===5CO2+2H2O。
①正极的电极反应是______________。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。 则 A 物质的化学式是___________。
(5)实验过程中,若在阴极产生了 44.8L(标准状况)气体,则熔融盐燃料电池消耗 CH4_____L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
设计实验证明酸性强弱顺序:HCl>H2CO3>H2SiO3。
(1)写出实验原理的化学反应方程式________________。
(2)设计本实验所依据的化学原理是________________。
(3)实验中必须用到的药品有________________,所需的实验仪器有________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。
C.氨气分子是极性分子而甲烷是非极性分子。
D.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com