
【题目】Ⅰ.回答下列问题:
(1)烃A的结构简式为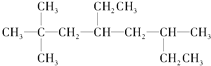 ,用系统命名法命名烃A:____________。
,用系统命名法命名烃A:____________。
(2)某烃的分子式为![]() ,核磁共振氢谱图中显示4个峰,则该烃的一氯代物有_______种,该烃的结构简式为____________。
,核磁共振氢谱图中显示4个峰,则该烃的一氯代物有_______种,该烃的结构简式为____________。
(3)麻黄素又称黄碱,是我国特定中药材麻黄中所含有的一种生物碱。经科学家研究发现其结构为: ,下列各物质:A.
,下列各物质:A. 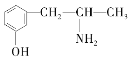 B.
B. ![]() C.
C. 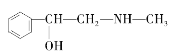 D.
D. 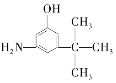 E.
E. 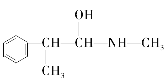
与麻黄素互为同分异构体的是_________(填字母,下同),互为同系物的是___________(填字母)。
Ⅱ.有机物C常用于食品行业。已知![]() 在足量
在足量![]() 中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重
中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重![]() 和
和![]() ,经检验剩余气体为
,经检验剩余气体为![]() 。
。
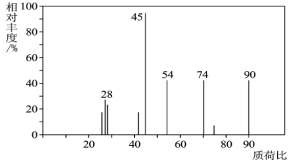
(1)C分子的质谱图如图所示,从图中可知其相对分子质量是________,则C的分子式是_______。
(2)C能与![]() 溶液发生反应,C一定含有的官能团是_____________。
溶液发生反应,C一定含有的官能团是_____________。
(3)C分子的核磁共振氢谱有4个峰,峰面积之比是![]() ,则C的结构简式是________。
,则C的结构简式是________。
(4)![]() 与
与![]() 的氢氧化钠溶液反应,需溶液的体积是_____
的氢氧化钠溶液反应,需溶液的体积是_____![]() 。
。
【答案】2,2,6-三甲基-4-乙基辛烷 4 ![]() DE C 90
DE C 90 ![]() 羧基或
羧基或![]()
![]() 100
100
【解析】
Ⅰ.(1)根据烷烃的命名原则命名;
(2)核磁共振氢谱图中显示4个峰,说明结构存在四种氢原子,据此分析解答;
(3)根据同分异构体和同系物的概念分析判断;
Ⅱ.根据最大质荷比可确定相对分子质量为90,根据生成的水和二氧化碳的计算含有的H和C的物质的量及质量,判断有机物中含有O元素的质量,再根据n(C)∶n(H)∶n(O)确定C的实验式和化学式,据此分析解答。
Ⅰ.(1) 为烷烃,最长碳链含有8个C,主链为辛烷,编号从距离甲基最近的一端开始,在2号C和6号C上各含有2个、1个甲基,在4号C含有1个乙基,该有机物名称为:2,2,6-三甲基-4-乙基辛烷,故答案为:2,2,6-三甲基-4-乙基辛烷;
为烷烃,最长碳链含有8个C,主链为辛烷,编号从距离甲基最近的一端开始,在2号C和6号C上各含有2个、1个甲基,在4号C含有1个乙基,该有机物名称为:2,2,6-三甲基-4-乙基辛烷,故答案为:2,2,6-三甲基-4-乙基辛烷;
(2)某烃的分子式为![]() ,核磁共振氢谱图中显示4个峰,为异戊烷,分子中含四种氢原子,生成的一氯代物四种,该烃结构简式为:CH3CH(CH3)CH2CH3,故答案为:4;CH3CH(CH3)CH2CH3;
,核磁共振氢谱图中显示4个峰,为异戊烷,分子中含四种氢原子,生成的一氯代物四种,该烃结构简式为:CH3CH(CH3)CH2CH3,故答案为:4;CH3CH(CH3)CH2CH3;
(3)分子式相同而结构不同的有机物互称同分异构体,题中D、E与麻黄素分子式相同,而结构不同,互为同分异构体,其中C与麻黄素的结构相似,分子组成上相差1个CH2原子团,互为同系物,故答案为:DE;C;
Ⅱ.(1)由图中最大质荷比可确定相对分子质量为90,5.4g水的物质的量为![]() =0.3mol,n(H)=0.6 mol,13.2g二氧化碳的物质的量为
=0.3mol,n(H)=0.6 mol,13.2g二氧化碳的物质的量为![]() =0.3mol,n(C)=n(CO2)=0.3 mol,此有机物9.0g含O元素质量为9.0g-0.6g-0.3×12 g=4.8 g,n(O)=
=0.3mol,n(C)=n(CO2)=0.3 mol,此有机物9.0g含O元素质量为9.0g-0.6g-0.3×12 g=4.8 g,n(O)=![]() =0.3 mol,故n(C)∶n(H)∶n(O)=0.3mol∶0.6mol∶0.3mol=1∶2∶1,因此实验式为CH2O,设分子式为(CH2O)n,A的相对分子质量为90,可得30n=90,解得:n=3,故有机物A为C3H6O3,故答案为:90;C3H6O3;
=0.3 mol,故n(C)∶n(H)∶n(O)=0.3mol∶0.6mol∶0.3mol=1∶2∶1,因此实验式为CH2O,设分子式为(CH2O)n,A的相对分子质量为90,可得30n=90,解得:n=3,故有机物A为C3H6O3,故答案为:90;C3H6O3;
(2)C能与NaHCO3溶液发生反应,说明C中含有羧基(-COOH),故答案为:羧基或-COOH;
(3)有机物C的分子式为C3H6O3,核磁共振氢谱有4个峰,峰面积之比是1∶1∶1∶3,则分子中4种H原子的数目为1、1、1、3,分子中含有1个-COOH、1个-CH3、1个![]() 、1个-OH,有机物C的结构简式为
、1个-OH,有机物C的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)有机物C含有1个-OH和1个-COOH,只有-COOH能够与NaOH反应,0.1molC消耗0.1molNaOH,需要1.0mol/L的氢氧化钠溶液的体积为![]() =0.1L=100mL,故答案为:100。
=0.1L=100mL,故答案为:100。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,则下列叙述中正确的是( )
A.同温同压下,NA个NO气体与NA个N2和O2的混合气体的体积相等
B.标准状况下,22.4LCCl4所含分子数为NA
C.4℃时,9mL水和标准状况下11.2L氮气含有相同的原子数
D.1.7gH2O2中含有的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿(含FeO·Cr2O3、Al2O3、SiO2等)为原料制备二草酸铬钾的实验步骤如下:
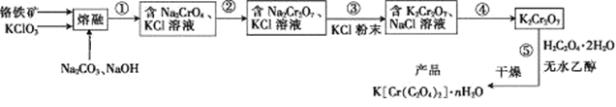
回答下列问题:
(1)若“熔融”在坩埚中进行,其材质可以是____(填“铁”、“陶瓷”或“SiO2”)。
(2) FeO·Cr2O3与KClO3及Na2CO3发生反应,生成Fe2O3、KCl、Na2CrO4和CO2的化学方程式为____________________________。
(3)熔融后的固体中含Na2CrO4、Fe2O3、Na2SiO3、NaAlO2、KCl等, 步骤①包含两次过滤操作:一是水浸后过滤;二是调节所得滤液pH为7~8,加热煮沸半小时,趁热过滤。第一次过滤滤渣中的主要成分为______,第二次过滤滤渣的主要成分为_________。
(4)步骤②需加入酸,则加入稀硫酸时发生反应的离子方程式为___________。
(5)步骤④包含的具体操作有_____、_____,过滤、洗涤,再经干燥得到K2Cr2O7晶体。(有关物质的溶解度曲线如图所示)

(6)已知K[Cr(C2O4)2]的相对分子质量为267。采用热重分析法测定K[Cr(C2O4)2]·nH2O样品所含结晶水数目,将样品加热到80 ℃时,失掉全部结晶水,失重16.8%。K[Cr(C2O4)2]·nH2O晶体中n=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g)
2N2(g)+3H2O(g) ![]() H<0。在恒容的密闭容器中,下列有关说法正确的是
H<0。在恒容的密闭容器中,下列有关说法正确的是
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡
C.平衡时,其他条件不变,增加NH3的浓度,逆反应速率将减小
D.其他条件不变,使用高效催化剂,废气中氮氧化物的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别取浓度不同、体积均为20.00mL的3种HCl溶液,分别滴入浓度为1.000mol·L-1,0.1000mol·L-1和0.01000mol·L-1的NaOH溶液,测得3个反应体系的pH随V(NaOH)的变化的曲线如图,在V(NaOH)=20.00mL前后出现突跃。下列说法不正确的是
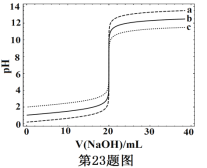
A. 3种HCl溶液的c(HCl):最大的是最小的100倍
B. 曲线a、b、c对应的c(NaOH):a>b>c
C. 当V(NaOH)=20.00mL时,3个体系中均满足:c(Na+)=c(Cl-)
D. 当V(NaOH)相同时,pH突跃最大的体系中的c(H+)最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在500 mL KNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6 mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
A. 电解得到的Cu的物质的量为0.5 mol
B. 向电解后的溶液中加入98 g的Cu(OH)2可恢复为原溶液
C. 原混合溶液中c(K+)=4 mol/L
D. 电解后溶液中c(H+)=2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)。
PCl3(g)+Cl2(g)。
编号 | 温度 /℃ | 起始物质 的量/mol | 平衡物质 的量/mol | 达到平衡 所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t |
Ⅱ | 320 | 0.80 | t1 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=![]() mol·L-1·s-1
mol·L-1·s-1
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学计盘在化学中占有重要地位,请回答下列问题。
(1)相同质量的SO2和SO3所含氧原子的个数比为______。
(2)质量相同的A、B两种气体,在同温同压下,A的分子数比B多,则A的密度_____ B的密度(填>、=、<)。
(3)焦亚硫酸纳(Na2 S2O5)是常用食品抗氧化剂,常用于葡萄酒、果脯等食品中。果脯中的Na2 S2O5的使用量是以游离的SO2来计算的,我国规定每千克果脯中SO2的最高含量是0.35g。
①下列试剂可用于检测SO2的是_________。
A.I2 B.HC1 C. H2SO4 D.CS2
②某500g果脯样品经检测得知含有SO2的物质的量为0.005 mol,该产品是否合格_________ (填“是”或“否”)。
(4)“84消毒液”是常用的含氯消毒剂,可以利用Cl2与NaOH反应制得该产品。反应的离子方程式为_______。“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84gcm-3)的浓硫酸配制1 000 mL 0.50 mol L-1的稀硫酸用于增强“84消毒液”的消毒能力。需用量筒量取浓硫酸的体积为_________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1799年由英国化学家汉弗莱·戴维发现一氧化二氮(N2O)气体具有轻微的麻醉作用,而且对心脏、肺等器官无伤害,后被广泛应用于医学手术中。
(1)一氧化二氮早期被用于牙科手术的麻醉,它可由硝酸铵在催化剂下分解制得,该反应的化学方程式为___。
(2)已知反应2N2O(g)=2N2(g)+O2(g) ΔH=-163kJ·mol-1,1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收945kJ、498kJ的能量,则1molN2O(g)分子中化学键断裂时需要吸收的能量为___kJ。
(3)一定温度下的恒容容器中,反应2N2O(g)=2N2(g)+O2(g)的部分实验数据如下:
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O)/mol·L-1 | 0.10 | 0.09 | 0.08 | 0.07 | 0.06 | 0.05 | 0.04 | 0.03 | 0.02 | 0.01 | 0.00 |
①在0~20min时段,反应速率v(N2O)为___mol·(L·min)-1。
②若N2O起始浓度c0为0.150mol·L-1,则反应至30min时N2O的转化率α=___。
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___(填“>”“=”或“<”)T2。当温度为T1、起始压强为p0时,反应至t1min时,体系压强p=___(用p0表示)。
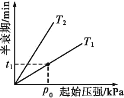
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g)=2I(g)(快反应)
第二步 I(g)+N2O(g)![]() N2(g)+IO(g)(慢反应)
N2(g)+IO(g)(慢反应)
第三步 IO(g)+N2O(g)![]() N2(g)+O2(g)+I(g)(快反应)
N2(g)+O2(g)+I(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是___(填标号)。
A.温度升高,k值增大
B.第一步对总反应速率起决定作用
C.第二步活化能比第三步大
D.I2的浓度与N2O分解速率无关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com