
【题目】如果阿伏加德罗常数的值为NA。下列说法正确的是( )
A.![]() 与
与![]() 所含的分子数一定相等
所含的分子数一定相等
B.将![]() 钠用铝箱包裹并刺小孔,与足量水充分反应生成H2分子数为
钠用铝箱包裹并刺小孔,与足量水充分反应生成H2分子数为![]()
C.![]() 与足量水反应转移
与足量水反应转移![]() 电子
电子
D.高温下,![]() 与足量水蒸气完全反应,转移的电子数为
与足量水蒸气完全反应,转移的电子数为![]()
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某充电宝锂离子电池的总反应为![]() 。某手机镍氢电池总反应为
。某手机镍氢电池总反应为![]() (M为储氢金属或合金),有关上述两种电池的说法错误的是
(M为储氢金属或合金),有关上述两种电池的说法错误的是
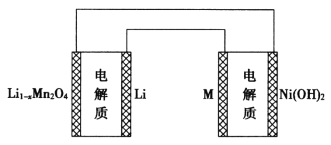
A.锂离子电池放电时,Li+移向正极
B.如图表示用锂离子电池给镍氢电池充电
C.锂离子电池充电时,阴极的电极反应式:![]()
D.镍氢电池放电时,正极的电极反应式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取硝基苯的主要步骤如下:
①将配制好的浓硫酸与浓硝酸的混合酸,冷却后加入试管中。
②向混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。
③水浴加热发生反应。
④反应结束后,待混合液冷却后转移至分液漏斗中,除去混合酸,粗产品依次用蒸馏水和10%的Na2CO3溶液洗涤,再用蒸馏水洗涤,得粗硝基苯。
⑤将粗硝基苯用无水CaCl2干燥后蒸馏得到纯硝基苯。

回答下列问题:
(1)配制一定比例浓硫酸和浓硝酸的混合酸的操作是___。
(2)步骤③中,水浴加热的优点是___。
(3)图中长玻璃导管的作用是___。
(4)写出制取硝基苯的化学方程式:___。
(5)步骤④中粗产品用10%的Na2CO3溶液洗涤的目的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有__________个。
②LiBH4由Li+和BH4-构成,BH4-的空间构型是__________,B原子的杂化轨道类型是_____。
③某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如下表所示:
I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_______(填元素符号),判断理由为_______________。
(2)铜晶体中铜原子的堆积方式如图所示,铜晶体中原子的堆积模型属于____________。

(3)A原子的价电子排布式为3s23p5,铜与A 形成化合物的晶胞如图所示(黑点代表铜原子)。
①该晶体的化学式为______________。
②该化合物难溶于水但易溶于氨水,其原因是_____________ ,此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为____________。
③己知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,己知该晶体中Cu原子和A原子之间的最短距离为体对角线的1/4,则该晶体中Cu原子和A原子之间的最短距离为________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的有害气体主要有NO、碳氢化合物及CO,某校同学设计实验将模拟汽车尾气转化为无害气体。回答下列问题;
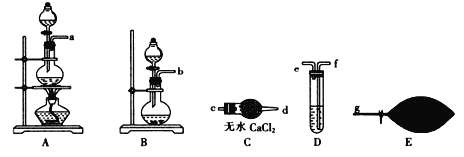
(1) 为了配制模拟尾气,甲组同学用上图所示装置分别制备NO、乙烯及CO三袋气体。
① 在实验室中用装置A制取NO,分液漏斗中盛放的是_______(填试剂名称)。
② 用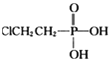 (乙烯利)与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为(已知磷转化为Na3 PO4)_______________________。
(乙烯利)与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为(已知磷转化为Na3 PO4)_______________________。
③ 用H2C2O4与浓硫酸制取CO的化学方程式:H2C2O4 ![]() CO↑ + CO2 ↑+ H2O↑,然后进行提纯,选用上图装置预制一袋干燥纯净的CO,各接口连接的顺序为(气流从左至右)___________→g,其中装置C中主要仪器的名称是________,装置D中盛放的药品是_______。
CO↑ + CO2 ↑+ H2O↑,然后进行提纯,选用上图装置预制一袋干燥纯净的CO,各接口连接的顺序为(气流从左至右)___________→g,其中装置C中主要仪器的名称是________,装置D中盛放的药品是_______。
(2) 乙组同学将甲组制得的气体与空气按适当比例混合形成模拟尾气(NO、CO、C2 H4及空气),按如图所示装置进行尾气转化并检验。
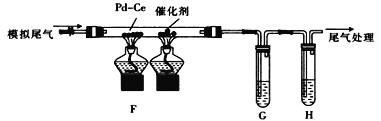
① 为检验催化反应后的气体中是否有CO2生成和乙烯的残留,G、H中盛放的试剂依次是_______(填标号)。
a. NaOH溶液 b. 酸性KMnO4溶液 c. 澄清石灰水 d. Br2/CCl4溶液
② 通“模拟尾气”前,需先将催化剂加热到反应所需的温度,其目的是__________________;写出其中CO与NO完全转化为无害气体的化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)![]() 碳与适量水蒸气反应生成CO和H2,需吸收
碳与适量水蒸气反应生成CO和H2,需吸收![]() 热量,此反应的热化学方程式为_________________
热量,此反应的热化学方程式为_________________
(2)已知![]() ;
;![]()
![]() ;
;![]()
![]() ;
;![]()
常温下,取体积比4:1的甲烷和氢气的混合气体![]() (标准状况下),经完全燃烧后恢复至室温,则放出的热量为___________
(标准状况下),经完全燃烧后恢复至室温,则放出的热量为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其平衡常数为K2。在温度973 K和
FeO(s)+H2(g),其平衡常数为K2。在温度973 K和
1173 K情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是________(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=_________。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=_________。
(3)能判断反应③已达平衡状态的是_________。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)根据反应①与②可推导出K1、K2与K3之间的关系式_________。据此关系式及上表数据,也能推断出反应③是____________(填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是_______(填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积
C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、碳等元素的单质及其化合物在化工医药、材料等领域有着广泛的应用。回答下列问题:
(1)Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为___,所含非金属元素的电负性由大到小的顺序为___。碳原子为____杂化,NO3-的空间构型为____。
(2)目前发现的铝原子簇Al13的性质与卤素相似,则原子簇Al13属于____晶体。Na[Al(OH)4]存在的化学键有 ___(填字母)。
A 离子键 B 极性键 C 非极性键 D 配位键 E 氢键 F 金属键
(3)已知:

反应后,当σ键增加了1 mol时,π键___(填“增加”或“减少”)了____个。
(4)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,如SO2分子中存在“离域π键”,可表示成π34,则![]() (咪唑)中的“离域兀键”可表示为_______
(咪唑)中的“离域兀键”可表示为_______
(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示。若晶体密度为d g·cm-3,则晶胞中最近的两个碳原子之间的距离为_____ pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒的原子结构示意图为____________________________;
(2)![]() 的中心原子价层孤电子对数目为______,一个
的中心原子价层孤电子对数目为______,一个![]() 离子中含有_______个
离子中含有_______个![]() 键;
键;
(3)![]() 巯基烟酸氧钒配合物
巯基烟酸氧钒配合物![]() 图
图![]() 是副作用小的有效调节血糖的新型药物。
是副作用小的有效调节血糖的新型药物。
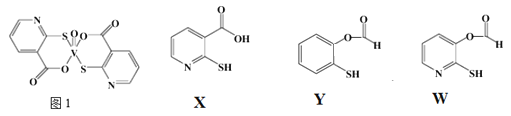
①该药物中N原子的杂化方式是_______;
②![]() 、Y、W三种物质在水中的溶解性由大到小的顺序为__________,原因是__________;
、Y、W三种物质在水中的溶解性由大到小的顺序为__________,原因是__________;
已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”
键”![]() 或大
或大![]() 键
键![]() 。大
。大![]() 键可用
键可用![]() 表示,其中m、n分别代表参与形成大
表示,其中m、n分别代表参与形成大![]() 键的原子个数和电子数,如苯分子中大
键的原子个数和电子数,如苯分子中大![]() 键表示为
键表示为![]() 。
。
③下列微粒中存在“离域![]() 键”的是_____;
键”的是_____;
![]()
![]()
![]()
![]()
④![]() 分子中大
分子中大![]() 键可以表示为_______________;
键可以表示为_______________;
(5)偏钒酸铵加热分解生成五氧化二钒、氨气、水。偏钒酸铵的阴离子呈如下图2所示的无限链状结构,则偏钒酸铵的化学式为_________;
(6)某六方硫钒化合物晶体的晶胞如图4所示![]()
![]() 表示V,
表示V,![]() 表示
表示![]() ,该晶胞的化学式为VS。图3为该晶胞的俯视图。
,该晶胞的化学式为VS。图3为该晶胞的俯视图。
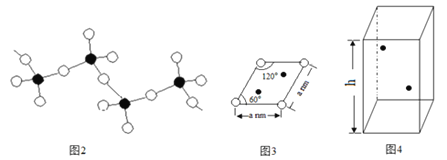
①请在图4中用![]() 标出V原子的位置;__________
标出V原子的位置;__________
②已知晶胞的密度为![]() ,计算晶胞参数
,计算晶胞参数![]() ____________cm。
____________cm。![]() 列出计算式即可
列出计算式即可![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com