
| 原子或分子相关信息 | 单质及其化合物相关信息 | |
| X | ZX4分子是由粗Z提纯Z的中间产物 | X的最高价氧化物对应的水化物为无机酸中最强酸 |
| Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种高温材料 |
| Z | Z原子的最外层电子数是次外层电子数的$\frac{1}{2}$ | Z广泛存在于无机非金属材料中,其单质是制取大规模集成电路的主要原料 |
| W | W原子的最外层电子数小于4 | W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
 ;X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为6H++Al2O3=2Al3++3H2O.
;X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为6H++Al2O3=2Al3++3H2O.分析 X、Y、Z为短周期元素,X的最高价氧化物对应的水化物为无机酸中最强酸,则X为Cl;Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料,Y原子的最外层电子数等于电子层数,则Y为Al;Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料,原子的最外层电子数是次外层电子数的$\frac{1}{2}$,则Z为Si;W原子的最外层电子数小于4,常见化合价有+3、+2,WX3稀溶液呈黄色,则W为Fe,据此解答各小题即可.
解答 解:X、Y、Z为短周期元素,X的最高价氧化物对应的水化物为无机酸中最强酸,则X为Cl;Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料,Y原子的最外层电子数等于电子层数,则Y为Al;Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料,原子的最外层电子数是次外层电子数的$\frac{1}{2}$,则Z为Si;W原子的最外层电子数小于4,常见化合价有+3、+2,WX3稀溶液呈黄色,则W为Fe,
(1)W为Fe,在周期表的位置为第四周期第Ⅷ族,Fe(OH)2在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:第四周期第Ⅷ族;4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(2)X的简单阴离子为Cl-,结构示意图为 ,X的最高价氧化物对应水化物为高氯酸,Y的氧化物为氧化铝,反应的离子方程式为:6H++Al2O3=2Al3++3H2O,
,X的最高价氧化物对应水化物为高氯酸,Y的氧化物为氧化铝,反应的离子方程式为:6H++Al2O3=2Al3++3H2O,
故答案为: ;6H++Al2O3=2Al3++3H2O;
;6H++Al2O3=2Al3++3H2O;
(3)Z的氧化物为二氧化硅,在通讯领域用来作光导纤维,工业上制备硅的单质的化学反应方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:光导纤维;Ge+2 H2O2+2NaOH=Na2GeO3+3H2O;
(4)YX3为AlCl3,AlCl3在熔融状态下不导电,说明AlCl3固体为共价化合物,存在的是共价键;
在50mL l mol•L-1的AlCl3溶液中逐滴加入0.5mol•L-1的NaOH溶液,若铝元素全部转化为氢氧化铝沉淀,可以得到氢氧化铝为0.05L×1mol/L×78g/mol=0.39g<1.56g,故可能是NaOH不足,部分铝离子沉淀生成氢氧化铝,也可能是铝离子部分转化偏铝酸根离子,部分转化为氢氧化铝沉淀,则加入NaOH溶液的体积可能二种情况,
故答案为:共价;二.
点评 本题考查结构性质位置关系应用,题目难度中等,侧重对元素化合物性质与常用化学用语考查,较好的考查学生对基础知识的掌握与灵活运用能力.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原则 | |
| B. | 6C的电子排布式1s22s22p${\;}_{x}^{\;}$2违反了洪特规则 | |
| C. | ns电子的能量不一定高于(n-1)p电子的能量 | |
| D. | 电子排布式(22Ti)1s22s22p63s23p10违反了泡利原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 东晋葛洪《肘后备急方》中记载了“青蒿一握,以水二升渍,绞取汁,…”,此过程属于物理变化 | |
| B. | 日本福岛核电站事故中,核原料裂变产生的2种放射性同位素碘-131和铯-137的中子数不同 | |
| C. | 乙烯与氧气在银催化作用下生成环氧乙烷符合绿色化学的原子经济性要求 | |
| D. | PM2.5是指天气中直径接近2.5×10-6m的颗粒物,其分散在空气中形成胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
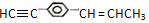 的说法正确的是( )
的说法正确的是( )| A. | 所有碳原子有可能都在同一平面上 | |
| B. | 最多只可能有9个碳原子在同一平面上 | |
| C. | 有7个碳原子可能在同一直线上 | |
| D. | 至少有6个碳原子在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属元素组成的化合物中只含共价键 | |
| B. | ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 | |
| C. | 同种元素的原子均有相同的质子数和中子数 | |
| D. | IA族金属元素是同周期中金属性最强的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验方案 | 现象 | 结论 |
| A | 向SiO2固体中加入足量盐酸 | 固体不溶解 | SiO2不溶于任何酸 |
| B | 向Na2CO3溶液中通入足量CO2 | 产生晶体 | 溶解度:NaHCO3>Na2CO3 |
| C | 向75%的酒精中加入小粒钠 | 产生气泡 | 乙醇与钠反应产生H2 |
| D | 向KI 淀粉溶液中通入气体X | 溶液变蓝 | X的氧化性比I2的氧化性强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | M的分子式为C9H10O4 | |
| B. | M与浓溴水既能发生取代反应,又能发生加成反应 | |
| C. | 一定条件下,1 mol M最多能与3molH2发生反应 | |
| D. | M能分别与Na、NaOH、NaHCO3发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 A>B>D>C | B. | 原子序数 d>c>b>a | ||
| C. | 离子半径 C>D>B>A | D. | 阴离子的还原性C2-<D- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com