
| A. | 品红溶液褪色---漂白性 | B. | 高锰酸钾溶液褪色---漂白性 | ||
| C. | 导致酸雨---酸性氧化物 | D. | 通入H2S溶液中变浑浊---氧化性 |
分析 SO2性质有:①具有酸性氧化物的通性;②具有还原性,被氧化剂氧化成SO3;③弱氧化性;④漂白性,能够和某些有色物质结合生成无色物质,但是不能漂白酸碱指示剂,以此解答该题,
A.二氧化硫具有选择漂白性
B.二氧化硫具有还原性和氧化性的高锰酸钾溶液发生氧化还原反应;
C.二氧化硫是硫酸型酸雨的形成原因;
D.二氧化硫中硫元素化合价处于+4价,具有弱氧化性,和硫化氢反应生成硫单质和水.
解答 解:A.SO2具有漂白性,能够和某些有色物质结合生成无色物质,但是不能漂白酸碱指示剂,能使品红溶液褪色,故A正确;
B.SO2具有还原性,被氧化剂氧化成SO3或者硫酸,故能使酸性KMnO4溶液褪色,故B错误;
C.SO2具有酸性氧化物的通性,空气中的二氧化硫能够和水反应生成亚硫酸,空气中氧化为硫酸,随雨水落下形成酸雨,二氧化硫是导致酸雨的原因,但酸性氧化物不一定形成酸雨,形成酸雨的物质是硫酸,故C错误;
D.二氧化硫中硫元素化合价处于+4价,具有弱氧化性,通入H2S溶液中变浑浊,反应为SO2+2H2S=3S+2H2O,二氧化硫表现的是氧化性,故D正确;
故选AD.
点评 本题考查二氧化硫的性质,为高频考点,侧重二氧化硫性质的考查,注重基础知识的夯实,注意相关物理性质的记忆,题目较简单.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+ | B. | Cl- | C. | Mg2+ | D. | Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、HCO3-、Na+、K+ | B. | NO3-、Ba2+、K+、Cl- | ||
| C. | Fe3+、NO3-、K+、H+ | D. | Al3+、SO42-、NH4+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除⑥外 | B. | 除⑤.⑥.⑦.⑧外 | C. | ①.②.⑥.⑦ | D. | ①.③.⑥.⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ•mol-1 | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242 kJ•mol-1 | D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-242 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
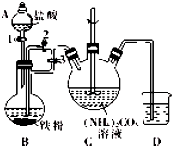 乳酸亚铁{[CH3CH(OH)COO]2Fe}广泛应用于乳制品、营养液等,能溶于水,可由乳酸与FeCO3反应制得.
乳酸亚铁{[CH3CH(OH)COO]2Fe}广泛应用于乳制品、营养液等,能溶于水,可由乳酸与FeCO3反应制得.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com