
| 实验操作与现象 | 实验结论 | 判断理由 | |
| 步骤一 | 加入过量NaOH溶液,得到蓝色沉淀; | 肯定有Cu2+、肯定无 | 肯定无该离子的理由 |
| 步骤二 | 将蓝色沉淀过滤、洗涤、灼烧得到24.0g固体; | Cu2+物质的量浓度为 | Cu元素守恒 |
| 步骤三 | 向上述滤液中加足量Ba(NO3)2溶液,得到46.6g不溶于稀硝酸的沉淀. | 肯定有Cl-、 | 肯定有Cl-的理由 |
| 24.0g |
| 80g/mol |
| 0.3mol |
| 0.1L |
| 46.6g |
| 233g/mol |
| 实验操作与现象 | 实验结论 | 判断理由 | |
| 步骤一 | CO32- | CO32-与Cu2+不共存 | |
| 步骤二 | 3 | ||
| 步骤三 | SO42- | 电荷守恒 |
| 0.2mol |
| 0.1L |


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
| B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C、加入硝酸银溶液有白色沉淀产生,一定有Cl- |
| D、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
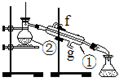
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
| 相对分子质量 | 32 | 122 | 136 |
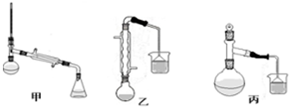
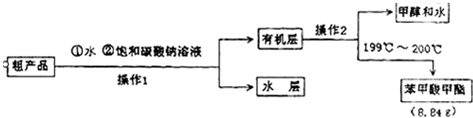
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁、四氧化三铁、冰水混合物 |
| B、金属钙、生石灰、碱石灰 |
| C、水银、空气、干冰 |
| D、二氧化硫、水蒸气、天然气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、该反应的化学平衡常数表达式是K=
| ||
| B、此时,B的平衡转化率是35% | ||
| C、增大该体系的压强,平衡向右移动,化学平衡常数 | ||
| D、增加C,B的平衡转化率不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com