
| A. | CO2+H2O═H2CO3 化合反应 | |
| B. | Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O 分解反应 | |
| C. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 置换反应 | |
| D. | NaCl+AgNO3═AgCl↓+NaNO3 复分解反应 |
分析 化合反应:两种或两种以上物质反应后生成一种物质的反应,其特点可总结为“多变一”;
分解反应:一种物质反应后生成两种或两种以上的物质,其特点可总结为“一变多”;
置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应;
复分解反应是两种化合物相互交换成分生成两种新的化合物的反应.据此分析.
解答 解:A、此反应符合“多变一”的特点,故为化合反应,故A正确;
B、此反应符合“一变多”的特点,故为分解反应,故B正确;
C、置换反应一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,此反应不符合,故C错误;
D、此反应是两种化合物相互交换成分生成两种新的化合物的反应,故为复分解反应,故D正确.
故选C.
点评 本题难度不大,掌握四大基本反应类型的种类、特征并能灵活运用等是正确解答本题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 该物质属于氢氧化物 | |
| B. | 该物质的摩尔质量是160g•mol-1 | |
| C. | 该物质的碱性不强 | |
| D. | 将1molNaAl(OH)2CO3溶于足量1mol•L-1HCl中时,共收集到2.5molCO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
物质 物质的量/mol 温度/℃ | NO | H2O |
| T1 | 1.6 | 2.4 |
| T2 | 1.2 | 1.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应过程 | 化学方程式 | 焓变△H(kJ/mol) | 活化能Ea(kJ/mol) |
| 甲烷氧化 | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸汽重整 | CH4(g)+H2O(g)=CO(g)+3H2(g) | 206.2 | 240.1 |
| CH4(g)+2H2O(g)=CO2(g)+4H2(g) | 165.0 | 243.9 |


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2 是氧化产物 | |
| B. | 1mol KClO3 参加反应,转移的电子为1mol | |
| C. | KClO3 在反应中被氧化 | |
| D. | H2C2O4的还原性强于ClO2 的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液 | B. | 硝酸银溶液 | C. | 碳酸钡粉末 | D. | 生石灰粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
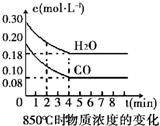 在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.CO和H2O浓度变化如右图,t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.CO和H2O浓度变化如右图,t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 强电解质 | 非电解质 | |
| A | NO2 | CuO | HF | KOH | H2SO4 | SO2 |
| B | CO2 | Na2O2 | HCl | Cu(OH)2 | HClO4 | CH4 |
| C | SiO2 | MgO | HClO | NH3•H2O | NaHCO3 | C2H5OH |
| D | Mn2O7 | K2O | HBr | Na2CO3 | Ba(OH)2 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com