
| A. | 大于20 mL | B. | 小于20 mL | C. | 等于20mL | D. | 等于5mL |
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L HCl溶于水后溶液中含有nA个HCl分子 | |
| B. | 1L 0.1 mol•L-1的Na2SO4溶液中含有0.2 nA个Na+ | |
| C. | 1 mol 硫酸钾中阴离子所带电荷数为nA | |
| D. | 将0.1mol氯化铁溶于1L水中,所得溶液含有0.1nAFe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将amol/L的Na2RO3溶液与bmol/L的NaHRO3溶液等体积混合后,若c(Na+)>c(HRO3-)>c(RO32-)>c(OH-)>c(H+),则a<b | |
| B. | 0.1mol•L-1NH4HS溶液中:c(NH4+)=c(HS-)+c(S2-)+c(H2S) | |
| C. | 若KHA溶液呈弱酸性,则c(K+)>c(A2-)>c(HA-)>c(H+)>c(OH-) | |
| D. | 向AgNO3溶液中逐滴滴加等物质的量浓度的KCl和K2CrO4的混合溶液,若先产生白色沉淀,则Ksp(AgCl)<Ksp(Ag2CrO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
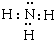 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
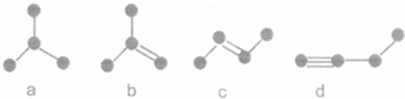
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
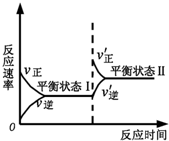
| A. | 反应达平衡时,正反应速率和逆反应速率相等 | |
| B. | 该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态Ⅱ | |
| C. | 该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ | |
| D. | 同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,2LpH=12的氨水中含有OH-数目为0.02NA | |
| B. | 氯碱工业中,外电路中转移电子数为0.3NA时产生气体体积(标准状况)为4.48L | |
| C. | 标准状况下,11.2LCH3Cl中非极性共价键数目等于2.0NA | |
| D. | 一定条件下,1molI2和0.2molH2混合充分反应,转移的电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com