
【题目】25℃时拟用0.10mol/L的氢氧化钠溶液滴定10mL浓度为0.10mol/L醋酸的滴定曲线如图所示。横坐标为加入氢氧化钠的体积,纵坐标为溶液的pH。回答下列问题:
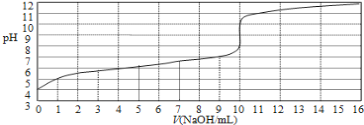
(1)该醋酸溶液的电离度α=______________。
(2)写出pH=7时溶液中离子浓度的大小关系:__________________________ 。
(3)为了准确指示终点本次滴定最好选用________做指示剂。
(4)写出滴入5mL氢氧化钠溶液时,溶液中的物料守恒关系:____________。
【答案】0.1% c(Na+)=c(CH3COO-)>c(H+)=c(OH-) 酚酞 2c(Na+)= c(CH3COOH)+ c(CH3COO-)
【解析】
由图可知,当NaOH的V=0mL时,0.10mol/L醋酸溶液的pH=4;当NaOH的V=10mL时,滴定曲线发生突变,说明达到了滴定终点;当NaOH的V=5mL时,醋酸反应一半,溶液中溶质为等物质的量的醋酸和醋酸钠,结合溶液中的三个守恒式分析解答。
(1)由图像可知,当NaOH的V=0mL时,0.10mol/L醋酸溶液的pH=4,可以认为醋酸电离出的c(H+)=110-4mol/L,醋酸的电离度为![]() =0.1%;
=0.1%;
(2)pH=7时溶液呈中性,根据电荷守恒,各离子的浓度大小关系为:c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
(3)当恰好中和时溶质是醋酸钠,属于强碱弱酸盐,水解显碱性,应选酚酞做指示剂;
(4)当NaOH的V=10mL时,滴定曲线发生突变,说明达到了滴定终点,则当NaOH的V=5mL时,醋酸反应一半,溶液中溶质为等物质的量的醋酸和醋酸钠,物料守恒关系为:2c(Na+)= c(CH3COOH)+ c(CH3COO-)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池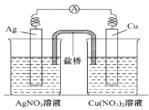 。以下有关该原电池的叙述正确的是( )
。以下有关该原电池的叙述正确的是( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①②B.②③C.②④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表中的信息判断,下列说法错误的是

A. 第①组反应的氧化产物为O2
B. 第②组反应中C12与FeBr2的物质的量之比小于或等于1:2
C. 第③组反应中生成3mol C12,转移6mol电子
D. 氧化性由强到弱的顺序为C1O3- >C12>Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在有机物:①CH3CH3、②CH2=CH2、③CH3CH2C≡CH、④CH3C≡CCH3、⑤C2H6、⑥CH3CH=CH2中,一定互为同系物的是_______,一定互为同分异构体的是________________(填编号);
(2)以五倍子为原料可制得A,A结构简式为下图所示,回答下列问题:
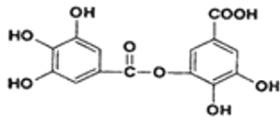
①A的分子式为______________;
②有机化合物B在硫酸催化条件下加热发生酯化可得到A。写出B的结构简式为_____ ;
(3)写出含有1个-CH2-、1个![]() 、3个-CH3原子团的烃类物质的结构简式___________;
、3个-CH3原子团的烃类物质的结构简式___________;
(4)写出核磁共振氢谱有两组峰,且峰面积之比为3:2,分子式为C8H10的芳香烃类化合物的结构简式_________;
(5)写出该有机物的名称![]() ________________。
________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 均为短周期元素,它们在元素周期表中的位置如图所示, ,若 W 原子的最外层电子数是内层电子总数的
,若 W 原子的最外层电子数是内层电子总数的![]() ,下列说法中正确的是( )
,下列说法中正确的是( )
A.阴离子的半径从大到小排列顺序为X>Y>Z>W
B.X、Y、Z、W元素的氢化物分子间都可以形成氢键
C.Y的两种同素异形体在常温下可以相互转化
D.最高价氧化物对应的水化物的酸性:W>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
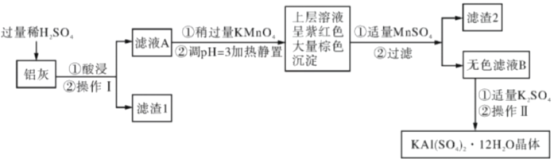
(1)明矾净水的原理是____________(用离子方程式表示)。
(2)操作Ⅱ是蒸发浓缩、__________、过滤、__________、干燥,
(3)检验滤液A中是否存在Fe2+的试剂是________________(只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是_________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+):________
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:_________________,滤渣2含有的物质是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种短周期元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族;A与B形成的离子化合物A2B中,所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子分子。试回答下列问题:
(1)写出对应元素的名称:A_____,C_____,E_____。
(2)写出下列物质的电子式:
①D元素形成的单质____;②A、B、E形成的化合物____;③D、E形成的化合物______。
(3)A和B可形成A2B、A2B2两种化合物,E与B可形成E2B、E2B2两种化合物,则下列说法不正确的是_____。
A.A2B2和E2B2中都含有非极性共价键
B.A2B和E2B都含离子键
C.A2B和A2B2中阴阳离子个数比均为1∶2
D.A2B和A2B2均能溶于E2B,并发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能一步实现的是( )
A.饱和NaCl溶液![]() NaHCO3(s)
NaHCO3(s) ![]() Na2CO3(s)
Na2CO3(s)
B.Cu2(OH)2CO3![]() CuCl2(aq)
CuCl2(aq) ![]() Cu(s)
Cu(s)
C.FeS2![]() SO3
SO3![]() H2SO4
H2SO4
D.Fe2O3![]() FeCl3(aq)
FeCl3(aq) ![]() Fe
Fe
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com