
【题目】关于原电池的说法正确的是( )
A.电流从原电池的负极流向正极
B.电子从发生还原反应的电极流出
C.原电池是将化学能转变为电能的一种装置
D.原电池的两个电极,一定是由活动性不同的两种金属组成
科目:高中化学 来源: 题型:
【题目】胶体区别于其他分散系的本质特征是( )
A.分散质粒子能做无规则运动
B.光线透过时能观察到光亮的通路
C.静置后既不分层,也无沉淀产生
D.分散质粒子直径在10-7~10-9m之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A、B是中学常见的物质,其阴、阳离子只能从下表中选择。
阳离子 | K+、Na+、Fe2+、Ba2+、NH4+ 、Ca2+ |
阴离子 | OH–、NO3–、I–、HCO3–、AlO2–、HSO4– |
(1)若A、B的水溶液均为无色,且A的水溶液呈强酸性,B的水溶液呈强碱性。混合后产生不溶于稀硝酸的白色沉淀及能使红色石蕊试纸变蓝色的气体。
①B的化学式为________________,生成的气体电子式为___________
②A、B溶液混合加热反应的离子方程式___________________________________。
(2)若A的水溶液呈浅绿色,B的水溶液无色且其焰色反应为黄色。向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合亦无明显变化。
①A的化学式为________________。
②经分析上述过程中溶液变黄的原因可能有两种:I._________________________、Ⅱ.____________________________________________。(用离子方程式表示)
③请用一简易方法证明上述溶液变黄的原因__________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入2mL盐酸于试管中。下列对烧杯中的实验现象的描述及原因说明中正确的是()

A. 烧杯中出现白色浑浊,原因是试管中的反应放出热量使烧杯中饱和石灰水温度升高,溶质析出
B. 烧杯中出现白色浑浊,原因是试管中的反应吸收热量使烧杯中饱和石灰水温度降低,溶质析出
C. 烧杯中没有任何现象,原因是试管中的反应与烧杯中饱和石灰水没有关系
D. 烧杯中没有任何现象,原因是试管中的反应既不放出热量,也不吸收热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充放电的化学方程式为:2K2S2+KI3 ![]() K2S4+3KI,装置(Ⅱ)为电解池的示意图。当闭合开关K时,X附近溶液先变红。则下列说法正确的是( )
K2S4+3KI,装置(Ⅱ)为电解池的示意图。当闭合开关K时,X附近溶液先变红。则下列说法正确的是( )

A. 闭合K时,K+从右到左通过离子交换膜
B. 闭合K时,A的电极反应式为:3I--2e-===I![]()
C. 闭合K时,X的电极反应式为:2Cl--2e-===Cl2↑
D. 闭合K时,当有0.1 mol K+通过离子交换膜,X电极上产生标准状况下气体1.12 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1 盐酸与 50 mL 0.55 mol·L -1 NaOH 溶液在图示的装置中进行中和反应。通过测定反应过程中的热量可计算中和热。回答下列问题:
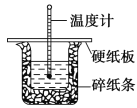
(1)从实验装置上看,图中尚缺少的一种玻璃用品是____________________
(2)烧杯间填满碎纸条的作用是______________________ 。
(3)从下列选项中选出倒入NaOH溶液的正确操作________
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(4)大烧杯上如不盖硬纸板,求得的中和热数值将______ (填“偏 大”、“偏小”或“无影响”)。
(5)实验中改用60 mL 0.50 mol·L-1 盐酸跟 50 mL 0.55 mol·L-1 NaOH 溶液进行反应,与上述实验相比,所放出的热量________(填“变大”、“变小”或“不变”),所求中和热________(填“变大”、“变小”或“不变”)
(6)用50 mL 0.50 mol·L-1 CH3COOH 溶液(已知CH3COOH 电离时吸热)进行上述实验,测得的中和热的数值会________。(填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在容积固定的密闭容器中充入CH4、CO2 发生此反应![]() ,下列选项可说明上述反应达到平衡状态的是( )。
,下列选项可说明上述反应达到平衡状态的是( )。
A. 混合气体的密度不再发生变化B. 混合气体的平均相对分子质量不再发生变化
C. 混合气体的总质量不再发生变化D. 相同时间内每断开2mol C=O键,同时断开1mol H-H键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图海水综合利用的工业流程图,判断下列说法正确的是( )
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。

A. 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B. 在过程②中将MgCl2·6H2O灼烧即可制得无水MgCl2
C. 从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程
D. 从第③步到第⑤步的目的是为了提纯Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.6molX气体和0.2molY气体混合于容积为2L的容器中,使其发生如下反应:3X(g)+Y(g)=nZ(g)+2W(g)。5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/ (L· min),则n的值为
A. 4B. 3C. 2D. 1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com