

| ||
| ||
| 1 |
| 2 |
| 1 |
| 2 |


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从反应开始到平衡过程中,用C来表示该反应的平均速率为0.005 mol?L-1?min-1 | ||
B、达平衡时压强变为原来的
| ||
| C、此温度下该反应的平衡常数为0.0125 | ||
| D、若保持温度和体积不变,向平衡体系中再加入0.2 molC(S)和0.3 mol H2O(g),重新达到平衡后,H2O的转化率等于16.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 . .挤压胶头滴管后会看到烧瓶中形成喷泉 |
B、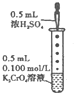 滴加几滴浓H2SO4后,溶液颜色由黄色变为橙色 |
C、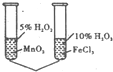 由该实验可以验证催化剂的催化效果 |
D、 能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某溶液中同时滴入几滴KSCN溶液和少量新制氯水 溶液变为红色 原溶液一定含有Fe2+ |
| B、向AgCl的饱和溶液中加入少量NaCl晶体 无明显现象 NaCl溶于水,阻止了AgCl的溶解 |
| C、相同温度下,测定等物质的量浓度的Na2CO3和Na2SiO3两溶液的pH 后者的pH大 碳的非金属性比硅强 |
| D、在溴水中加入少量某有机物,充分振荡、静置 溴水褪色 该有机物中含有碳碳双键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com