
【题目】(1)某强酸性溶液X可能含有A13+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、C1-中的一种或几种,取该溶液进行连续实验,实验过程如下:
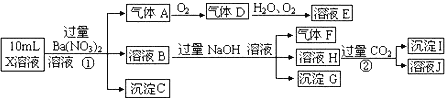
根据以上信息,回答下列问题:
上述离子中,溶液X中除H+外还肯定含有的离子是__________
请设计简单的实验检验不能确定是否含有的离子(若不止一种,可任选一种)的存在:
写出反应①的离子方程式 ;
④假设测定A、F、I均为0.1mol,100mL X溶液中n(H+)=0.4mol,当沉淀C物质的量大于0.7mol时,溶液X中还一定含有 .
(2)实验室常见的几种气体发生装置如图A、B、C所示:
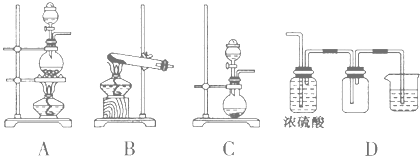
①实验室可以用B或C装置制取氨气,如果用B装置制取氨气其化学反应方程式为 。
②气体的性质是选择气体收集方法的主要依据.下列气体的性质与收集方法无关的是 (填序号,下同).
A.密度 B.颜色 C.溶解性 D.热稳定性 e.与氧气反应
③若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的 (填序号).
A.CO2 B.NO C.Cl2 D.H2 e.HCl
其中在D装置中连接烧杯的目的是
【答案】(1)①Al3+、NH4+、Fe2+、SO42-
②取少量X溶液于试管中,加入几滴KSCN溶液,若溶液变红色则说明有Fe3+,反之则无Fe3+(或取少量B溶液于试管中,加入几滴AgNO3溶液,若有白色沉淀则说明有Cl-,反之则无Cl-)(或取少量X溶液于试管中,滴加Ba(NO3)2溶液至不再产生沉淀,再取上层清液于另一试管向其中滴加AgNO3溶液,若有白色沉淀则说明有Cl-,反之则无Cl-)
③3Fe2++4H++NO3—=3Fe3++NO↑+2H2O、Ba2++SO42-=BaSO4↓④Fe3+
(2)①2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O②bd③c,尾气处理
CaCl2+2NH3↑+2H2O②bd③c,尾气处理
【解析】
试题分析:强酸性溶液X中不可能存在与氢离子发生离子反应的离子,所以CO32-、SO32-一定不存在;加入硝酸钡溶液有气体产生,所以该溶液中存在与硝酸发生氧化还原反应的离子Fe2+,气体A是NO,因为不存在CO32-、SO32-,所以一定存在SO42-;沉淀C是硫酸钡沉淀;溶液B中含有硝酸钡、硝酸铁等,加入过量氢氧化钠溶液,有气体产生,则原溶液中一定存在NH4+;氢氧化钠与硝酸铁反应生成沉淀氢氧化铁,所以G中一定含有氢氧化铁;溶液H中通入过量二氧化碳,与溶液中的氢氧根离子、钡离子反应生成的是碳酸氢钡,所以产生的沉淀一定有氢氧化铝沉淀,所以原溶液中一定含有Al3+。
(1)①根据以上分析,该溶液中一定存在的是Al3+、NH4+、Fe2+、SO42-;
②铁离子与氯离子不能确定,证明铁离子是否存在,取少量X溶液于试管中,加入几滴KSCN溶液,若溶液变红色则说明有Fe3+,反之则无Fe3+;证明氯离子是否存在,取少量B溶液于试管中,加入几滴AgNO3溶液,若有白色沉淀则说明有Cl-,反之则无Cl-;
③反应①是硝酸与亚铁离子的氧化还原反应,离子方程式是3Fe2+ + 4H++ NO3—=3Fe3++NO↑+2H2O,同时还有硫酸钡沉淀产生,方程式为Ba2++SO42- =BaSO4 ↓;
④A、F、I均为0.1mol,说明NO的物质的量是0.1mol,则溶液中Fe2+ 的物质的量是0.3mol,铵根离子的物质的量是0.1mol,铝离子的物质的量是0.1mol,沉淀C的物质的量大于0.7mol也即硫酸根离子的物质的量大于0.7mol,根据电荷守恒,n(H+)+ 3n(Al3+)+ n(NH4+)+2 n(Fe2+)<2n(SO42-),所以该溶液中一定存在Fe3+;
(2)①采用B装置制备氨气时应选择用氢氧化钙和氯化铵固体加热反应,化学反应方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
②选择气体收集方法,不需要考虑气体颜色和热稳定性,依据气体密度,是否与空气中的氧气反应来选择排空气方法收集,依据气体是否溶于水判断收集气体是否能用排水方法或排其他液体的方法,故答案为bd;
③AD连接是利用向上排气法收集气体;吸收装置是能用液体吸收气体防止污染空气;制取CO2时不需要加热也不不必处理尾气,NO常温下与氧气发生反应,不能用向下排空气法收集,氢气尾气处理时一般采用点燃的方法,制取HCl一般不需要加热,故X可能是氯气;D装置中连接烧杯的目的是用来吸收尾气,防止污染空气。


科目:高中化学 来源: 题型:
【题目】100mL3mol/LH2SO4溶液跟过量铁粉反应,在一定温度,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
A.硫酸钾溶液 B.1mol/LH2SO4溶液 C.碳酸钠固体 D.金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在定容密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在定容密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:l的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A、①④⑥ B、②③⑤ C、①③④ D、①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)离子推断题:
有一未知的无色溶液,可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Fe3+、Al3+,NO3-、CO32-、SO42-,现取两份100mL溶液进行如下实验:
①第一份加入足量的BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,称量沉淀质量为6.99g;
②第二份逐滴滴加NaOH溶液,测得沉淀的物质的量与NaOH溶液的体积关系如下图所示。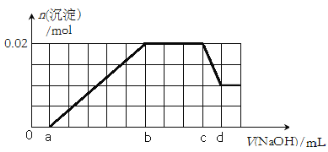
根据上述实验事实,回答以下问题:
(1)该溶液中一定不存在的阳离子有 ;
(2)在实验②中,NaOH溶液滴至b~c段过程中发生的离子反应方程式为 ;NaOH溶液的浓度为 (用含字母c、d的代数式表示);
(3)确定原溶液一定含有Mg2+、Al3+、H+,其物质的量之比n(Mg2+):n(Al3+):n(H+)为 (填数字,下同);
(4)原溶液中NO3-的浓度为c(NO3-),则c(NO3-)的取值范围为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在一定条件下可以合成乙醇(CH3CH2OH):2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到化学平衡状态的是
CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到化学平衡状态的是
A、CO在该条件下达到最大转化率
B、正反应和逆反应的化学反应速率均为零
C、反应容器中CO、H2和CH3CH2OH共存
D、反应体系中H2 与CH3CH2OH 的物质的量浓度为4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯和乙醇的混合气体V L,完全燃烧后生成CO2和H2O,消耗相同状态下的氧气3VL。则混合气体中乙烯和乙醇的体积比( )
A.2 : 1 B.1 : 1 C.1:2 D.任意比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下:
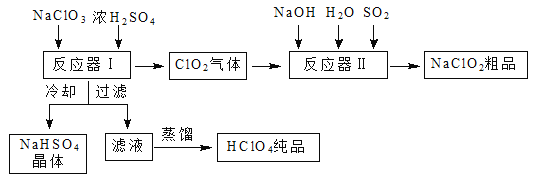
已知:① NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。
② 高氯酸是至今为止人们已知酸中的最强酸,沸点90 ℃。
请回答下列问题:
(1)反应器Ⅰ中发生反应的化学方程式为 ,冷却的目的是 。
(2)反应器Ⅱ中发生反应的离子方程式为 。
(3)通入反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2的原因是 。
(4)Ca(ClO)2、ClO2、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,请写出工业上生产漂白粉的离子方程式: 。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。ClO2的有效氯含量为 。(结果保留两位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com