
【题目】科学家利用回旋加速器进行实验,成功制成115号元素的原子。该原子在生成数秒后衰变成113号元素,115号元素的一种核素为![]() 。下列有关叙述中正确的是
。下列有关叙述中正确的是
A.核素![]() 的中子数为174B.115号与113号元素互为同位素
的中子数为174B.115号与113号元素互为同位素
C.113号元素的原子的质量数为113D.115号元素衰变成113号元素是化学变化
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A. 16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
B. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
C. pH=1的HCl溶液中,含有0.1NA个H+
D. 0.1mol苯乙烯分子中,含有碳碳双键的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL 0.1molL-1NaOH溶液中加入0.1molL-1的一元酸HA溶液pH的变化曲线如图所示.下列说法正确的是( )
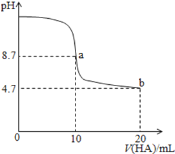
A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B. b点所示溶液中c(A-)>c(HA)
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. a、b两点所示溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是________(填“I”或“Ⅱ”);
②下表所列数据是反应I在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断△H1________0 (填“>”、“=”或“<”);
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为________,此时的温度为________(从上表中选择);
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=﹣1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=﹣566.0kJ/mol
③H2O(g)=H2O(l) △H=﹣44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________;
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
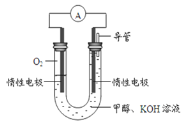
①该电池正极的电极反应为___________;
②工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发清洁能源是当今化工研究的一个热点问题。二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)CH3OH(g) ΔH1=-99kJ·mol1
②2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol1
③CO(g)+H2O(g)CO2(g)+H2(g) ΔH3=-41.2kJ·mol1
(1)催化反应室中的总反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),计算ΔH=_______。反应来自煤的气化。已知该反应的平衡常数表达式为K=![]() ,每生成1mol H2需要吸收131.3kJ的热量。写出该反应的热化学方程式____________。
,每生成1mol H2需要吸收131.3kJ的热量。写出该反应的热化学方程式____________。
(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6mol·L1,c(H2)=1.4mol·L1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为__________。
(3)在t℃时,反应②的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c(mol·L1) | 0.46 | 1.0 | 1.0 |
此时刻v正___v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是___。
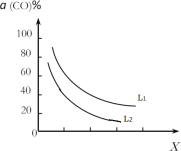
(4)在(1)小题中催化反应室的总反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图所示,图中X代表___(填“温度”或“压强”),且L1___L2(填“>”“<”或“=”)。
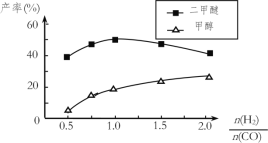
(5)在催化剂的作用下同时进行三个反应,发现随着起始投料比![]() 的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:_____。
的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al、Ti、Co、Cr、Zn 等元素形成的化合物在现代工业中有广泛的用途。回答下列问题:
(1)下列状态的铝中,电离最外层的一个电子所需能量最小的是_____(填标号)。
A.[Ne]3s1 B.[Ne]3s2 C.[Ne]3s23p1 D.[Ne] 3s13p2
(2)熔融 AlCl3 时可生成具有挥发性的二聚体 Al2Cl6,二聚体 Al2Cl6 的结构式为_____;(标出配位键)其中 Al 的配位数为_________。
(3)与钛同周期的所有副族元素的基态原子中,最外层电子数与基态钛原子相同的元素有_____种。
(4)Co2+的价电子排布式_________。NH3 分子与 Co2+结合成配合物[Co(NH3)6]2+,与游离的氨分子相比,其键角∠HNH_____(填“较大”,“较小”或“相同”),解释原因_____。
(5)已知 CrO5 中铬元素为最高价态,画出其结构式:_____。
(6)阿伏加德罗常数的测定有多种方法,X 射线衍射法就是其中的一种。通过对碲化锌晶体的 X 射线衍射图 象分析,可以得出其晶胞如图 1 所示,图 2 是该晶胞沿 z 轴的投影图,请在图中圆球上涂“●”标明 Zn 的位置_____。若晶体中 Te 呈立方面心最密堆积方式排列,Te 的半径为 a pm,晶体的密度为 ρg/cm3,阿伏加德罗常数 NA=_____mol-1(列计算式表达)。
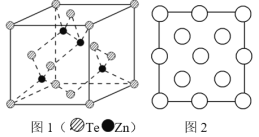
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是
实验 | 试剂甲 | 试剂乙 | 试剂丙 | 实验结论 |
|
A | 浓硝酸 | 铜片 | 淀粉—KI溶液 | 氧化性:NO2>I2 | |
B | 稀硫酸 | FeS | 含AgNO3的AgCl浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
C | 浓氨水 | CaO | 紫色石蕊溶液 | 氨水呈碱性 | |
D | 稀盐酸 | 石灰石 | BaCl2溶液 | 丙中生成BaCO3沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表短周期的一部分,请参照元素①~⑨在表中的位置,回答下列问题。
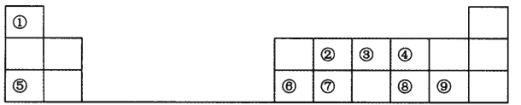
(1)元素②在周期表中的位置是______________。
(2)元素⑤和⑨形成的化合物的电子式为__________________。
(3)元素④、⑤、⑥形成的简单离子的半径依次__________________(填“增大”“减小”或“不变”)。
(4)表中元素②、③、⑦最高价含氧酸的酸性由强到弱的顺序是_____________(填化学式)。
(5)元素⑥形成的单质可与⑤的最高价氧化物对应的水化物发生反应,其反应的离子方程式为___________
(6)在一定条件下,①与③可形成一种化合物X,其相对分子质量与O2相同,且X可在纯氧中燃烧,所得产物对环境均无污染,则X燃烧的化学方程式为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国成功研制出了具有自主知识产权的治疗缺血性脑梗死新药——丁苯酞。有机物G是合成丁苯酞的中间产物,G的一种合成路线如下:

已知:
回答下列问题:
(1)A的结构简式是___________,E的化学名称是____________。
(2)由B生成C的化学方程式为______________________。
(3)G的结构简式为__________________。合成丁苯酞的最后一步转化为:
 ,则该转化的反应类型是_______________。
,则该转化的反应类型是_______________。
(4)有机物D的溴原子被羟基取代后的产物J有多种同分异构体,其中含有苯环的同分异构体有______种(不包括J),其核磁共振氢谱吸收峰最多的结构简式为_________。
(5)参照题中信息和所学知识,写出用![]() 和CH3MgBr为原料(其他无机试剂任选)制备
和CH3MgBr为原料(其他无机试剂任选)制备![]() 的合成路线:______________。
的合成路线:______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com