
分析 (1)根据温度对仪器的使用是否有影响判断;
(2)滴定管精确到0.01,量筒精确到0.1;
(3)A.量筒的小刻度在下方,俯视读数会导致量取的液体体积偏小;
B.滴定管小刻度在上方,俯视读数读出的是液面上方的刻度,导致读数偏小;
C.根据c=$\frac{n}{V}$计算不当操作对n或V的影响,如果n偏小或V偏大,则所配制溶液浓度偏低;
(4)根据游码的标示是否是物质的质量计算;
(5)化学实验中,凡是需要对反应的温度进行控制的反应均需要用到温度计,据此进行判断;
(6)实验中的加热、冷却、称量的操作步骤要重复进行,直至连续两次称量的差不超过0.1 g为止,至少重复操作2次、称量4次;
(7)先需要加入氢氧化钠溶液将苯酚转化成苯酚钠,然后通过分液存在电离出苯酚和苯酚钠溶液,然后加入酸将苯酚钠转化成苯酚,再通过分液得到苯酚;
(8)根据指示剂的变色范围与酸碱中和后的越接近越好,且变色明显(终点变为红色)进行判断.
解答 解:(1)液体的体积受温度的影响,温度不同时,量筒、容量瓶、滴定管中的液体的体积不同,导致产生误差,所以标是使用温度的仪器为abc,
故答案为:abc;
(2)量筒和滴定管能用来量取液体,能精确量取液体体积的是滴定管,
故答案为:c;
(3)A.俯视液面读数,溶液体积偏小,所配溶液浓度偏小,故A正确;
B.滴定管刻度从上到下逐渐变大,俯视滴定管内液面读数,读出的溶液体积偏小,故B正确;
C.定容时俯视刻度线,使溶液的体积偏小,所配溶液浓度偏大,故C错误;
故答案为:AB;
(4)称量物体时,游码的数值要加在砝码一边,物体与砝码放反位置时,砝码的质量等于物体的质量加上游码的质量,称量10.5g物体时,砝码的质量是10g,游码的质量数值是0.5g,物体的质量是10g-0.5g=9.5g,
故答案为:9.5;
(5)B.①实验室乙醇和浓硫酸制乙烯,需要加热至170℃,需要使用温度计;
②乙醛的银镜反应,需要水浴加热,不需要使用温度计;
③酚醛树脂的制取,需要使用水浴加热,不需要使用温度计;
④乙酸乙酯的水解需要水浴加热,不需要使用温度计;
⑤石油的分馏,需要温度计测定馏分的温度;
根据分析可知,使用温度计的为①⑤,
故答案为:①⑤;
(6)在硫酸铜结晶水含量的测定实验中,实验中的加热、冷却、称量的操作步骤要重复进行,直至连续两次称量的差不超过0.1 g为止,一般情况下,结晶水含量测定时称量次数不得少于4次,
故答案为:4;
(7)苯酚与苯互溶,在分离苯和苯酚的实验中,需要先加入碱溶液将苯酚转化成苯酚钠,通过分液分离出苯;再向苯酚钠溶液中加入酸,将苯酚转化成不溶于水的苯酚,再通过分液分离出苯酚,所以至少进行2次分液操作,
故答案为:2;
(8)甲基橙的变色范围是3.1-4.4,用酸滴定碱时,甲基橙加在碱里,达到滴定终点时,溶液颜色由黄变红,易于观察,
故答案为:甲基橙.
点评 本题考查实验基本操作方法、常见仪器的使用方法,题目难度中等,注意掌握常见仪器的构造及使用方法,明确化学实验基本操作方法,试题知识点较多,题量较大,充分考查学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
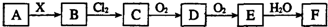
| A. | 当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4 | |
| B. | 当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3 | |
| C. | B和Cl2的反应是氧化还原反应 | |
| D. | 当X是强酸时,C在常温下是气态单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石能源物质内部贮存着大量的能量 | |
| B. | 绿色植物进行光合作用时,将太阳能转化为化学能贮存起来 | |
| C. | 物质的化学能可以在不同条件下转化为热能、电能为人类所利用 | |
| D. | 吸热反应中由于反应物的总能量小于生成物的总能量,因而没有利用价值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56g铁粉在1mol氯气中充分燃烧,失去的电子数为3NA | |
| B. | 标准状况下22.4升CH4和C2H4的混合气体所含氢原子数为4NA28bNA | |
| C. | 常温常压下,3.4gNH3中含N-H键数目为0.6NA | |
| D. | CO2通过足量Na2O2使固体增重bg时,反应中转移的电子数为$\frac{b{N}_{A}}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 预期现象与结论 | |
| 步骤1 | 取反应后干燥的固体ag于试管中,加入足量的1mol/L CuSO4溶液,充分振荡,经固液分离、洗涤后,再向固体中滴加足量的3mol/LH2SO4,振荡溶解,过滤后将滤液配成250mL溶液,待用. | - |
| 步骤2 | 取少量步骤1中滤液于试管中,滴加1~2滴20%KSCN | 溶液变红色,则固体产物含+3价铁 |
| 步骤3 | 取少量步骤1中滤液于试管中,滴加1~2滴0.01mol/LKMnO4 | 溶液紫色褪去,则固体产物含+2价铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠和盐酸溶于水都发生电离,克服粒子间作用力的类型相同 | |
| B. | 金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子 | |
| C. | HI的分子质量大于HF,所以HI的沸点高于HF | |
| D. | 由IA族和VIA族元素形成的原子个数比为l:1,离子个数比为2:l的化合物是含有共价键的离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com