
| A. | c(OH-)═c(H+)+c( HA-) | B. | c(Na+)═2c(A2-)+2c(HA-) | ||
| C. | c(A2-)+c(HA-)+c(H2A)═0.1mol•L-1 | D. | c(Na+)+c(H+)═c(OH-)+c(HA-)+2c(A2-) |
分析 该二元酸第一步完全电离,第二步部分电离,根据物料守恒和电荷守恒确定离子浓度关系,注意HA-只电离不水解.
解答 解:A.根据质子守恒得c(OH-)=c(H+)+c( HA-),故A正确;
B.根据物料守恒得c(Na+ )=2c(A2-)+2c( HA),故B正确;
C.HA-只电离不水解,所以溶液中不含 H2A,故C错误;
D.溶液呈电中性,阴阳离子所带电荷相等,所以c(Na+ )+c(H+)=c(OH- )+c( HA-)+2c(A2-),故D正确;
故选C.
点评 本题考查离子浓度大小的比较,易错选项是C,注意HA-只电离不水解,很多学生认为HA-既电离又水解而导致出错,为易错点.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:解答题
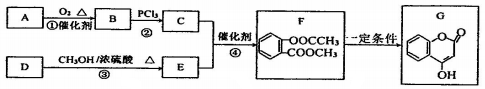
 +CH3COCl$\stackrel{催化剂}{→}$
+CH3COCl$\stackrel{催化剂}{→}$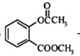 +HCl.
+HCl.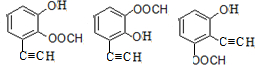 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 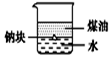 用图装置证明ρ(煤油)<ρ(钠)<ρ(水) | B. | 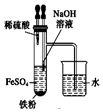 用图装置制备Fe(OH)2 | ||
| C. | 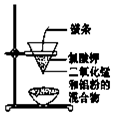 用图装置制取金属锰 | D. | 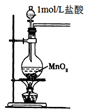 用图装置制取氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 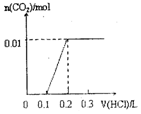 | B. | 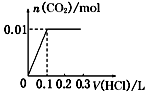 | C. | 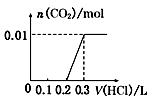 | D. | 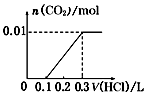 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 3:2 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
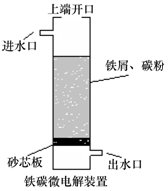 铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图.若上端开口关闭,可得到强还原性的H•(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的•OH(羟基自由基).下列说法正确的是( )
铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图.若上端开口关闭,可得到强还原性的H•(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的•OH(羟基自由基).下列说法正确的是( )| A. | 无论是否鼓入空气,负极的电极反应式均为Fe-3e-=Fe3+ | |
| B. | 鼓入空气时,每生成1mol•OH有2mol电子发生转移 | |
| C. | 不鼓入空气时,正极的电极反应式为H++e-=H• | |
| D. | 处理含有C2O42-的污水时,上端开口应关闭 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
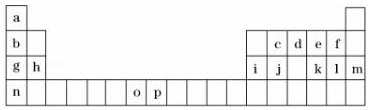
| 元素 | O | P | |
| 电离能/KJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
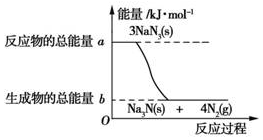 减少交通事故除遵守交通法规正确驾驶外,安全措施也极为重要.汽车的安全气嚢内有叠氮化钠(NaN3)与硝酸铵(NH4NO3)等物质.当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生分解反应,产生大量气体,充满气囊,从而保护驾驶员和乘客的安全.
减少交通事故除遵守交通法规正确驾驶外,安全措施也极为重要.汽车的安全气嚢内有叠氮化钠(NaN3)与硝酸铵(NH4NO3)等物质.当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生分解反应,产生大量气体,充满气囊,从而保护驾驶员和乘客的安全.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com