
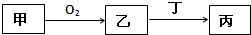 已知甲、乙、丙三种物质均含有同一种短周期元素,其中甲为单质,其转化关系如图,下列说法不正确的( )
已知甲、乙、丙三种物质均含有同一种短周期元素,其中甲为单质,其转化关系如图,下列说法不正确的( )

 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
| t/℃ | 700 | 800 | 850 | 1000 | 1200 |
| K1 | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |

| 起始浓度 | 甲 | 乙 | 丙 |
| c(CO2)(mol/L) | 0.01 | 0.02 | 0.02 |
| c(H2)(mol/L) | 0.01 | 0.01 | 0.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| 甲 | 187 | 202 | 2.6 |
| 乙 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A、B、C、D各由两种元素组成,甲、乙、丙是三种单质。这些常见的化
合物与单质之间存在如下关系(已知化合物C是一种有机物),

以下结论不正确的是 ( )
A.上图所示的五个转化关系中,有三个是化合反应
B.上述转化关系所涉及的化合物中有一种是电解质
C.甲、乙、丙三种单质的晶体均是分子晶体
D.上图所示的五个转化关系中,均为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
已知下列两个反应:
反应Ⅰ:CO2(g)+H2(g) CO(g)+H2O(g) △H1
CO(g)+H2O(g) △H1
反应Ⅱ:CO(g)+H2O(g) CO2(g)+H2(g) △H2
CO2(g)+H2(g) △H2
(1)相同温度下,若上述反应I的化学平衡常数为K1,反应Ⅱ的化学平衡常数为K2。那么K1·K2=_______。
(2)反应I的化学平衡常数K1和温度t的关系如下表一:



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com