
【题目】H2S 和SO2 会对环境和人体健康带来极大的危害,工业上采取多种方法来减少这些有害气体的排放。
I.H2S 的除去
方法1: 生物脱H2S,反应的原理为H2S + Fe2(SO4)3==S↓+2FeSO4+H2SO4、4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3 +2H2O。
2Fe2(SO4)3 +2H2O。
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105 倍,该菌的作用是______。
(2)由图1和图2 判断,使用硫杆菌的最佳条件为_________。若反应温度过高,反应速率下降,其原因是______________。


方法2: 在一定条件下,用H2O2 氧化H2S
(3)随着参加反应的n(H2O2)/n(H2S) 变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物 的分子式为________。
II.SO2 的除去
方法1( 双碱法): 用NaOH 吸收SO2 ,并用CaO 使NaOH 再生:NaOH 溶液![]() Na2SO3
Na2SO3
(4)写出过程①的离子方程式:_________________。
(5)CaO 在水中存在如下转化:CaO(s)+H2O(1)= Ca(OH)2(s)![]() Ca2+(aq) +2OH- (aq)。从平衡移动的角度,简述过程②NaOH再生的原理:_______________。
Ca2+(aq) +2OH- (aq)。从平衡移动的角度,简述过程②NaOH再生的原理:_______________。
方法2:用氨水除去SO2
(6)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0mol/L,溶液中的c(OH-)=________。将SO2 通入该氨水中,当c(OH-)降至1.0×10-7mol/L时,溶液中的c (SO32-)/c(HSO3-) =_________。
【答案】 催化作用(或作催化剂) 30℃、pH=2.0 硫杆菌失去活性(或蛋白质变性) H2SO4 2OH-+SO2=SO32-+H2O SO32-与Ca2+生成CaSO3沉淀,平衡向正向移动,有NaOH生成 6.0×10-3mol·L-1 0.62
【解析】试题分析:本题考查外界条件对化学反应速率和化学平衡的影响,化学图像的分析,得失电子守恒的应用,电离平衡常数的计算。
I(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,硫杆菌能明显加快反应速率,硫杆菌的作用是作催化剂。
(2)由图1知使用硫杆菌的最佳温度为30℃,由图2知使用硫杆菌的最佳pH为2.0,使用硫杆菌的最佳条件为30℃、pH=2.0。若温度过高,硫杆菌受热发生变性失去活性,反应速率下降。
(3)在反应中H2O2作氧化剂被还原成H2O,1molH2O2反应得到2mol电子,当n(H2O2)/n(H2S)=4时,根据得失电子守恒,4molH2O2反应得到8mol电子,1molH2S氧化失去8mol电子,则氧化产物为H2SO4(反应的化学方程式为4H2O2+H2S=H2SO4+4H2O)。
II(4)过程①为用NaOH溶液吸收SO2生成Na2SO3,反应的化学方程式为:SO2+2NaOH=Na2SO3+H2O,反应的离子方程式为:SO2+2OH-=SO32-+H2O。
(5)向Na2SO3溶液中加入生石灰,生石灰与水作用产生Ca2+,SO32-与Ca2+生成CaSO3沉淀,平衡向正向移动,有NaOH生成。
(6)氨水中存在电离平衡:NH3·H2O![]() NH4++OH-,溶液中c(NH4+)=c(OH-),由于NH3·H2O的电离程度很小,c(NH3·H2O)=2.0mol/L-c(NH4+)
NH4++OH-,溶液中c(NH4+)=c(OH-),由于NH3·H2O的电离程度很小,c(NH3·H2O)=2.0mol/L-c(NH4+)![]() 2.0mol/L,NH3·H2O的Kb=1.8
2.0mol/L,NH3·H2O的Kb=1.8![]() 10-5=[c(NH4+)·c(OH-)]/ c(NH3·H2O)= c2(OH-)/2.0,c(OH-)=6
10-5=[c(NH4+)·c(OH-)]/ c(NH3·H2O)= c2(OH-)/2.0,c(OH-)=6![]() 10-3mol/L。25℃时c(OH-)=1
10-3mol/L。25℃时c(OH-)=1![]() 10-7mol/L的溶液中c(H+)=1
10-7mol/L的溶液中c(H+)=1![]() 10-7mol/L ,H2SO3的Ka2=[c(H+)·c(SO32-)]/c(HSO3-),则c(SO32-)/c(HSO3-)= Ka2/ c(H+)=6.2
10-7mol/L ,H2SO3的Ka2=[c(H+)·c(SO32-)]/c(HSO3-),则c(SO32-)/c(HSO3-)= Ka2/ c(H+)=6.2![]() 10-8
10-8![]() (1
(1![]() 10-7)=0.62。
10-7)=0.62。


科目:高中化学 来源: 题型:
【题目】将适量的Cl2通入溴化钠溶液中,等反应停止后,实验室从该溶液中提取溴通常所需的主要仪器和方法是( )
A. 蒸发皿:蒸发后灼烧
B. 烧杯:冷却、结晶、过滤
C. 分液漏斗:分液
D. 分液漏斗:加萃取剂,振荡静置分层后分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《天工开物》中记载丝织品的处理:“凡帛织就犹是生丝,煮练方熟。练用稻稿灰入水煮。以猪胰脂陈宿一晚,入汤浣之,宝色烨然。”下列有关说法不正确的是
A. 生丝的主要成分为蛋白质
B. 稻稿灰含有碳酸钾,其入水后溶液呈碱性
C. 该过程实际就是生丝的除杂过程
D. 生丝煮练之后变为熟丝,熟丝的成分是氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列叙述,推测可能属于金属晶体的是( )
A.由分子间作用力结合而成,熔点很低
B.固体或熔融状态下易导电,熔点在1000℃左右
C.由共价键结合成空间网状结构,熔点很高
D.固体不导电,熔融状态下亦不导电,但溶于水后能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要配制2mol/L稀硫酸250mL.
(1)需要量取质量分数为98%密度为1.84g/mL的浓硫酸mL.
(2)配制过程中除了烧杯量筒,玻璃棒,还需要哪些仪器
(3)容量瓶使用前应先检漏,请简述捡漏的操作方法
(4)下列实验操作中,按先后顺序排列为 . A.将稀释、冷却后的硫酸沿玻璃棒注入250mL容量瓶中.
B.将洗涤液也注入容量瓶中,轻轻摇动容量瓶,使溶液混合均匀.
C.将量取的浓硫酸沿玻璃棒缓慢注入烧杯中,搅拌并冷却至室温.
D.向烧杯中加入约100mL蒸馏水.
E.用适量蒸馏水洗涤烧杯2~3次.
F.向容量瓶中加蒸馏水到液面接近刻度1cm~2cm处.
G.盖上瓶塞,并反复倒转摇匀.
H.用胶头滴管加蒸馏水到瓶颈刻度处.
(5)由于错误操作,判断得到的实际浓度与理论数据的偏差(填偏大,偏小或无影响) A、用量筒量取一定量液体时,俯视液面读数
B、容量瓶刚用蒸馏水洗净,没有烘干
(6)最后将所配溶液存放在试剂瓶中,并贴上标签,请你填写该标签(如图). 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是( )
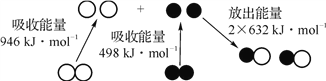
A. 放电条件下,N2(g)和O2(g)混合能直接化合生成NO(g)
B. NO是一种酸性氧化物,能用NaOH溶液处理含NO的尾气
C. N2(g)和O2(g)反应生成 NO(g),相当于N2(g)在O2(g)燃烧,该反应放热
D. 28 g N2(g)和32 g O2(g)完全反应生成 NO(g),放出的能量为180 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用锌粒和稀硫酸反应制取氢气,下列措施不能使反应速率加快的是( )
A.降低反应温度
B.滴加少量硫酸铜溶液
C.适当的增加硫酸的浓度
D.锌粉代替锌粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g)K=0.1。反应前CO的物质的量为10 mol,平衡后CO的物质的量为8 mol,下列说法正确的是( )
COS(g)+H2(g)K=0.1。反应前CO的物质的量为10 mol,平衡后CO的物质的量为8 mol,下列说法正确的是( )
A. 通入CO后,正反应速率逐渐增大
B. H2S的平衡转化率约为28.6%,CO的平衡转化率为80%
C. 平衡后H2S的质量为170 g
D. 升高温度,H2S浓度增加,表明该反应的逆反应是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com