
| A. | ①④⑤⑥ | B. | ②③⑤⑥ | C. | ②④⑤⑥ | D. | ①②③④ |
分析 化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论.
解答 解:①CO2、CO的物质的量浓度之比决定于开始加入的多少盒反应程度,与平衡状态无关,故错误;
②C为固体,平衡正向移动,气体质量增大,逆向移动,气体质量减小,所以混合气体的密度不变说明反应达到平衡状态,故正确;
③反应前后气体物质的量不同,所以压强不变说明反应达到平衡状态,故正确;
④生成二氧化碳和生成C都是逆反应,其速率之比始终等于化学计量数之比,不能说明反应达到平衡状态,故错误;
⑤单位时间内生成nmolCO2 的同时生成2nmolCO,说明正逆反应速率相等,反应达到平衡状态,故正确;
⑥C的质量不再改变,说明正逆反应速率相等,反应达到平衡状态,故正确;
故选B.
点评 本题考查化学平衡状态的判断,题目难度不大,要注意把握平衡状态的特征.


科目:高中化学 来源: 题型:选择题
| A. | ⑥⑤④③ | B. | ⑦①⑤③ | C. | ⑧②⑤③ | D. | ⑨①⑤③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. ,结构式为H-O-H.
,结构式为H-O-H.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②③④ | B. | 只有④ | C. | 只有③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4,C2H4,C3H6任意体积比 | |
| B. | CH4,C3H6,C2H2保持C3H6:C2H2=1:2(物质的量之比) | |
| C. | C2H6,C4H6,C2H2同条件下体积比为2:1:2 | |
| D. | C3H8,C4H8,C2H2质量比为11:14:26 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
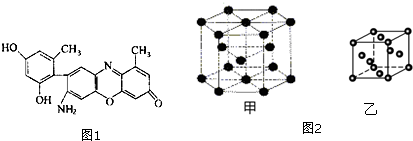
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
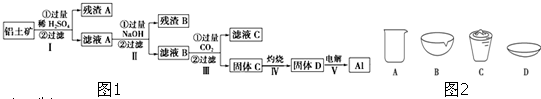
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com