
 如图所示,当线路接通时,发现M(用紫色石磊试液浸过的滤纸)a端显蓝色,b端显红色,且知甲中电极材料是锌-银,乙中电极材料是铂-铜 且乙中两极不发生变化,回答:
如图所示,当线路接通时,发现M(用紫色石磊试液浸过的滤纸)a端显蓝色,b端显红色,且知甲中电极材料是锌-银,乙中电极材料是铂-铜 且乙中两极不发生变化,回答:

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室里有一瓶KCl和CaCl2的固体混合物,通过下述实验方法可以确定该混合物中KCl和CaCl2的质量比,也可得到纯净的氯化钾.根据实验步骤填写下列空白.
实验室里有一瓶KCl和CaCl2的固体混合物,通过下述实验方法可以确定该混合物中KCl和CaCl2的质量比,也可得到纯净的氯化钾.根据实验步骤填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 4.20 | 25.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验目的 | 操作 | 实验现象 | 结论 |
| 1.检验Cl- | 取少许滤液于试管中, | 含有Cl- | |
| 2.检验NH4+ | 取少许滤液于试管中, | 含有NH4+ | |
| 3.检验Zn2+ | 取少许滤液于试管中,加入 稀氨水 | 先产生白色沉淀,继续加入氨水,沉淀又溶解 | 含有Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
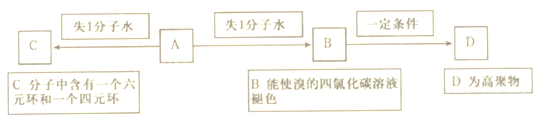
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①⑤ | B、③⑥ | C、②⑥ | D、②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com