
| A.形成原电池后,原电池中的阳离子移向负极 |
| B.铜锌原电池的正极是锌,电解质溶液可以是稀硫酸 |
| C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 |
| D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源:不详 题型:单选题
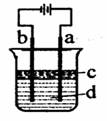
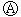 为直流电源,
为直流电源,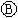 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后(此时开关处于打开状态)发现
为电镀槽.接通电路后(此时开关处于打开状态)发现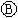 上的c点显红色。接通
上的c点显红色。接通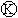 使c、d两点短路后,可以实现铁上镀锌。下列叙述正确的是
使c、d两点短路后,可以实现铁上镀锌。下列叙述正确的是
| A.a为直流电源的负极 | B.c极发生的反应为2H++2e-=H2↑ |
| C.f电极为锌板 | D.e极发生还原反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
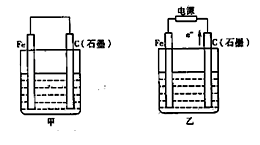
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe-2e=Fe2+ | B.2H2O+O2+4e=4OH- | C.4OH- -4e=2H2O+O2 | D.2H++2e=H2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
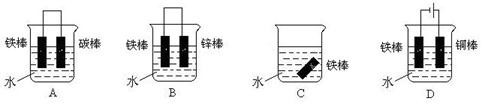
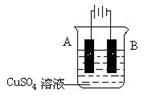
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe-2e- | B.2H2O+O2+4e- |
| C.2Fe+2H2O+O2 | D.Fe-3e- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com