
如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL1.0mol/L。
(1)A为 池,(填原电池、或电解池),其中的Ag极为 极,发生 反应(填“氧化”或“还原”)。
(2)B装置中的电极b极为 极,电极反应式为 ,总反应的化学方程式为 。经过一段时间后,B装置中溶液的碱性 (填“增强”、“减弱”或“不变”)
(3)若工作一段时间后,当Zn片质量减少3.25g时,a极逸出的气体在标准状况下的体积为 L。
(1)原电池;正;还原
(2)阴;2H++2e-=H2↑;2NaCl+2H2O 2NaOH+H2↑+Cl2↑;增强; (3)1.12
2NaOH+H2↑+Cl2↑;增强; (3)1.12
解析试题分析:(1)锌与硫酸铜可以发生自发的氧化还原反应,因此A装置是原电池。原电池中较活泼的金属作负极,则锌是负极失去电子,发生氧化反应,银是正极,溶液中的铜离子在正极得到电子发生还原反应。
(2)B装置是电解池,b电极与原电池的负极相连作阴极,溶液中的氢离子放电,电极反应式为2H++2e-=H2↑。A电极与原电池的正极相连,作阳极,溶液中的氯离子放电生成氯气,则B装置中总的化学方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑。B装置中有氢氧化钠强碱生成,因此溶液的碱性增强。
2NaOH+H2↑+Cl2↑。B装置中有氢氧化钠强碱生成,因此溶液的碱性增强。
(3)若工作一段时间后,当Zn片质量减少3.25g时,其中锌的物质的量是3.25g÷65g/mol=0.05mol,根据电极反应式Zn-2e-=Zn2+可知导线中转移电子的物质的量是0.05mol×2=0.1mol。a极电极反应式为2Cl--2e-=Cl2↑,则根据电子转移守恒可知逸出的氯气在标准状况下的体积为0.05mol×22.4L/mol=1.12L。
考点:考查电化学原理的应用


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
(8分)某课外活动小组用下图进行实验,试回答下列问题。
(1)若开始时开关K与a连接,则B极的电极反应式为 ;
(2)若开始时开关K与b连接,则B极的电极反应式为 ;
总反应的离子方程式为 ;
(3)当开关K与b连接时,下列说法正确的是(填序号) 。
①溶液中Na+向B极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加入适量的盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24L气体,则溶液中转移了0.2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程如下:

请回答下列问题:
(1)电镀污泥的主要成分是 (写化学式)。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为:
。
(3)析出CuCl晶体时的最佳pH在 左右。
(4)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装。真空干燥,密封包装的目的是 。
(5)从滤液A中可回收的主要物质是 (写化学式)。
(6)以碳棒为电极电解CuCl2溶液可得到CuCl。写出电解CuCl2溶液后的阴极上发生的反应为
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某实验小组用以下几个实验装置探究电化学过程对金属与稀硫酸反应速率的影响, 烧杯中都盛有稀H2SO4。



试回答:
(1)B装置中Cu电极上的电极反应式为 ,D装置中Fe电极上的电极反应式为 。
(2)D装置中的实验现象有 ,若用电流表测量反应时通过导线的电子流量为0.2mol,则Fe电极的质量变化为 。
(3)B、C两个装置中Fe片被腐蚀的速率更快的是 (填B或C)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)(1)右图为阳离子交换膜法电解饱和食盐水(滴有酚酞)原理示意图,E口产生H2,电解食盐水的离子方程式为: ,溶液变红色的是: 区(填A或B)。
(2)电化腐蚀是钢铁发生腐蚀的主要原因,又可分为吸氧腐蚀和析氢腐蚀,发生吸氧腐蚀的电极反应式:负极 正极
(3)下图是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计

此装置中进行的反应是可逆反应,其反应方程式式为:AsO43-+2I-+H+ AsO33-+I2+H2O,向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是 D电极上的电极反应式为
AsO33-+I2+H2O,向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是 D电极上的电极反应式为
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊试液,下列实验现象中正确的是( )
| A.逸出气体的体积a电极的小于b电极的 |
| B.一电极逸出无味气体,另一电极逸出刺激性气味气体 |
| C.a电极附近呈红色,b电极附近出现蓝色 |
| D.a电极附近呈蓝色,b电极附近出现红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知甲池的总反应式为: 2CH3OH+3O2+4KOH 2K2CO3+6H2O
(1)请回答图中甲、乙两池的名称。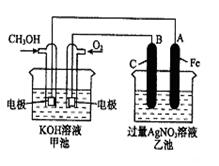
甲池是 装置;乙池是 装置。
(2)请回答下列电极的名称:通入CH3OH的电极名称是 ,B(石墨)电极的名称是 。
(3)写出电极反应式:通入O2的电极的电极反应式是 。
(4)乙池中反应的化学方程式为 。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铅蓄电池是典型的可充型电池,电池总反应为:Pb+PbO2+4H++2S 2PbSO4+2H2O。
2PbSO4+2H2O。
请回答下列问题(不考虑氢、氧的氧化还原):
放电时,正极的电极反应是 ;电解液中H2SO4的浓度将变 ;当外电路通过1 mol电子时,理论上负极板的质量增加 g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
新型锂离子电池材料Li2MSiO4(M为Fe,Co,Mn,Cu等)是一种发展潜力很大的电池电极材料。工业制备Li2MSiO4有两种方法。
方法一:固相法,2Li2SiO3+FeSO4 Li2FeSiO4+Li2SO4+SiO2。
Li2FeSiO4+Li2SO4+SiO2。
方法二:溶胶-凝胶法,CH3COOLi、Fe(NO3)3、Si(OC2H5)4等试剂 胶体
胶体 干凝胶
干凝胶 Li2FeSiO4。
Li2FeSiO4。
(1)固相法中制备Li2FeSiO4过程采用惰性气体气氛,其原因是
______________________________________________________________________。
(2)溶胶凝胶法中,检查溶液中有胶体生成的方法是________;生产中,生成1 mol Li2FeSiO4整个过程转移电子的物质的量为________mol。
(3)以Li2FeSiO4和嵌有Li的石墨为电极材料,含锂的导电固体作电解质,构成电池的总反应式为Li+LiFeSiO4 Li2FeSiO4,则该电池的负极是________;充电时,阳极反应的电极反应式为________。
Li2FeSiO4,则该电池的负极是________;充电时,阳极反应的电极反应式为________。
(4)使用(3)组装的电池必须先________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com