
| A、铁丝在硫蒸气中燃烧 | B、过量的Fe与稀HNO3反应 | C、红热的铁和水蒸气反应 | D、Fe(OH)2露置有空气中变质 |
| ||
| ||


科目:高中化学 来源: 题型:


| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
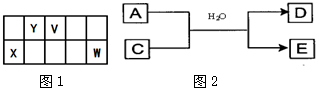
(1)X元素位于周期表中第__________族(用字母表示)。
(2)X、Y、Z三种元素形成的单质中,氧化性最弱的是_____________(填化学式)。
(3)Y与Z可形成共价化合物Y2Z2,分子中Y与Z均满足8电子稳定结构,则Y2Z2的电子式为_____________。
(4)a溶液的pH_____________7(填“>”“<”或“=”),用离子方程式解释为_____________,若在a溶液中加入少量镁粉,可观察到的现象是_____________。
(5)取pH=0的W的最高价氧化物对应水化物的溶液100.0 mL于某容器中,加入
若设Cu、Ag的物质的量分别为x、y。欲求算x、y的值,可列出下列计算式:
Ⅰ.64x+108y=0.90,该计算式是依据________________________关系列出的;
Ⅱ.2x+y=1 mol·L -1×
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)X元素位于周期表中第____________族(用字母表示)。
(2)X、Y、Z三种元素形成的单质中,氧化性最弱的是____________________(填化学式)。
(3)Y与Z可形成共价化合物Y2Z2,分子中Y与Z均满足8电子稳定结构,则Y2Z2的电子式为_________________________________。
(4)a溶液的pH___________7(填“>”“<”或“=”),用离子方程式解释为__________________,若在a溶液中加入少量镁粉,可观察到的现象是_________________________________。
(5)取pH=0的W的最高价氧化物对应水化物的溶液100.0 mL于某容器中,加入
若设Cu、Ag的物质的量分别为x、y。欲求算x、y的值,可列出下列计算式:
Ⅰ.64x+108y=0.90,该计算式是依据_____________________________________关系列出的;
Ⅱ.2x+y=1 mol·L -1×
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com