
【题目】二氯化锡可用于染料、香料、制镜、电镀等工业,是一种重要的化工原料。实验室制备二氯化锡可分三个过程完成,具体实验如下:
已知:①常温下四氯化锡是无色易流动的液体,熔点-33℃,沸点114.1℃,易溶于水。
②二氯化锡:遇水强烈水解,在浓盐酸中溶解度大且有利于SnCl2·2H2O的生成。
I.四氯化锡的制备。所需装置如图所示:
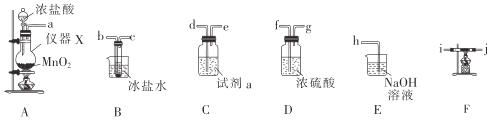
(1)仪器X的名称是___。
(2)试剂a是___,冰盐水的作用是__。
(3)按气流从左到右的顺序连接好装置:a___。
II.SnCl2·2H2O的制备
将装置B中得到的无色液体全部倒入锥形瓶中并加入适量浓盐酸,慢慢加入锡粉直至不能溶解,过滤后即得到SnCl2·2H2O。
(4)加入适量浓盐酸的作用是___。
(5)加入锡粉发生的反应为___。
III.SnCl2·2H2O的脱水,步骤如下:
a.将得到的SnCl2·2H2O置于干燥的50mL烧杯中,加入足量醋酸酐(CH3COOOCCH3)溶解。
b.将烧杯放入通风橱内,约5分钟搅拌一次,30分钟后在干燥的布氏漏斗上过滤。
c.用3~5mL乙醚淋洗产品,将产品转移至表面血,放入干燥器中干燥30分钟后,称重。
(6)SnCl2·2H2O脱水步骤a中加入醋酸酐后得到的有机物的结构简式是___。
(7)设计实验检测制得的SnCl2中是否有SnCl4:___。
【答案】圆底烧瓶 饱和食盐水 冷凝SnCl4 defgijbch或defgjibch 抑制SnCl2的水解 Sn+SnCl4=2SnCl2(或Sn+2HCl+2H2O=SnCl2·2H2O+H2↑) CH3COOH 称量19.0g产品,加入适量稀硝酸酸化,再加入足量AgNO3,充分反应,若得沉淀质量大于28.7g,则说明产品中有SnCl4
【解析】
I.由制备原理及实验装置可知,A中发生MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,然后连接C(试剂为饱和食盐水)可除去氯气中的HCl,再连接D可干燥氯气,然后连接F,F中发生Sn+2Cl2
MnCl2+Cl2↑+2H2O,然后连接C(试剂为饱和食盐水)可除去氯气中的HCl,再连接D可干燥氯气,然后连接F,F中发生Sn+2Cl2 ![]() SnCl4,连接B可冷凝分离出SnCl4,最后连接E可吸收尾气;
SnCl4,连接B可冷凝分离出SnCl4,最后连接E可吸收尾气;
II.SnCl2溶液易水解,在浓盐酸中溶解度大且有利于SnCl22H2O的生成,在B中加Sn反应生成SnCl2(或SnCl22H2O);
III.由实验可知SnCl22H2O脱水,利用醋酸酐脱水生成乙酸和SnCl2;SnCl2、SnCl4中Cl元素的质量分数不同,可检测混合物中Cl元素的含量判断SnCl2中是否有SnCl4。
(1)根据图示,仪器X是圆底烧瓶,故答案为:圆底烧瓶;
(2)浓盐酸易挥发,制得的氯气中会含有氯化氢杂质,试剂a是除去氯气中的氯化氢杂质的,应该选用饱和食盐水;常温下四氯化锡是无色易流动的液体,冰盐水可以冷凝SnCl4,故答案为:饱和食盐水;冷凝SnCl4;
(3)由上述分析可知,装置的连接顺序为A→C→D→F→B→E,且导管长进短出,则按气流从左到右的顺序连接好装置:adefgijbch或adefgjibch,故答案为:defgijbch或defgjibch;
(4)二氯化锡遇水强烈水解,在浓盐酸中溶解度大且有利于SnCl2·2H2O的生成,因此加入适量浓盐酸可以抑制SnCl2的水解,故答案为:抑制SnCl2的水解;
(5)加入锡粉发生的反应为Sn+SnCl4=2SnCl2(或Sn+2HCl+2H2O=SnCl22H2O+H2↑),故答案为:Sn+SnCl4=2SnCl2(或Sn+2HCl+2H2O=SnCl22H2O+H2↑);
(6)SnCl22H2O脱水步骤a中加入醋酸酐,醋酸酐是用来脱水的,醋酸酐与水反应生成的有机物是CH3COOH,故答案为:CH3COOH;
(7)由于![]() 、
、![]() 两者所含
两者所含![]() 元素的质量分数不同,可以通过测量一定质量的混合物中的
元素的质量分数不同,可以通过测量一定质量的混合物中的![]() 的含量进行推断,具体方法为:称量19.0g(0.1mol
的含量进行推断,具体方法为:称量19.0g(0.1mol![]() )产品,加入适量稀硝酸酸化,再加入足量硝酸银,充分反应,若得沉淀质量大于28.7g(0.2molAgCl),则说明产品中有SnCl4,故答案为:称量19.0g产品,加入适量稀硝酸酸化,再加入足量硝酸银,充分反应,若得沉淀质量大于28.7g,则说明产品中有SnCl4。
)产品,加入适量稀硝酸酸化,再加入足量硝酸银,充分反应,若得沉淀质量大于28.7g(0.2molAgCl),则说明产品中有SnCl4,故答案为:称量19.0g产品,加入适量稀硝酸酸化,再加入足量硝酸银,充分反应,若得沉淀质量大于28.7g,则说明产品中有SnCl4。


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】将镁铝铁合金投入到300 mL硝酸溶液中,金属恰好完全溶解生成Mg2+、Al3+和Fe3+;硝酸全部被还原为一氧化氮,其体积为6.72 L(标准状况),当加入300 mL某浓度氢氧化钠溶液时,金属阳离子恰好全部沉淀,干燥后测得质量为27.2 g。下列有关推断正确的是( )
A. 参加反应的硝酸的物质的量为0.9 mol
B. 参加反应的金属的质量为11.9 g
C. 硝酸的物质的量浓度为3 mol·L-1
D. 氢氧化钠的物质的量浓度为6 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年的化学诺贝尔奖颁给了为锂电池研究作出贡献的三位科学家,其研究的是两种常见锂电池:一种是采用镍钴锰酸锂Li(NiCoMn)O2或镍钴铝酸锂为正极的“三元材料锂电池”;另一种是采用磷酸铁锂(LiFePO4)为正极的电池。请回答下列问题:
(1)利用FeSO4、(NH4)2HPO4、LiOH为原料以物质的量之比1∶1∶1反应生成LiFePO4,该化学反应方程式为________________。
(2)Mn位于元素周期表的_____区(填“s”或“p”或“d”或“ds”或“f”),基态钴原子的未成对电子数为______,1mol [CoCl (NH3)5] Cl2 中含σ键数目为__NA。
(3)磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3,这四种酸中酸性最强的是_____。PO43-的空间构型是___,中心原子的杂化方式是______。
(4)PH3是_____分子(填“极性”或“非极性”),其在水中的溶解性比NH3小,原因是______。
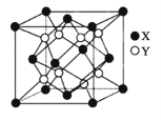
(5)硫化锂Li2S(摩尔质量Mgmol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag·cm-3,则距离最近的两个S2-的距离是_______nm。(用含a、M、NA的计算式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为研究水垢的生成,查得CaCO3和Mg(OH)2溶解度曲线如图所示。已知:40°C时,Ksp(MgCO3)=7×10-6,下列有关分析错误的是( )

A.CaCO3、Mg(OH)2溶解均放热
B.MgCl2溶液中加入少量CaCO3粉末加热搅拌,有Mg(OH)2生成
C.含有Ca(HCO3)2和Mg(HCO3)2的自来水长时间加热,水垢的主要成分为CaCO3和MgCO3
D.40℃时,Ksp(CaCO3)=1.6×10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期瑞士科学院研发出一种负载氧化铜的纳米晶粒的聚合物氮化碳二维纳米材料(类石墨相氮化碳),大幅度提高水分解的催化效率,将为实现氢能源大规模应用打下坚实的基础。回答下列问题:
(1)铜在周期表中的位置为___,其原子核外电子排布的最高能层符号为___。
(2)1989年A.Y.Liu和M.L.Cohen根据β-氮化硅的晶体结构,用C替换Si,从理论上预言了β-氮化碳这种硬度可以和金刚石相媲美的新共价化合物。

①石墨晶体可以一层层剥离开来,层间的作用力主要是___。
②类石墨相氮化碳中1、2、3、4共四个原子的空间构型为___;β-氮化碳中N的杂化类型是___。
③β-氮化碳的化学式为___;从化学键键长的角度分析金刚石、β-氮化碳的硬度大小:__。
(3)CuO晶胞如图:

①若氧化铜晶胞中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为___。
②NA代表阿伏加德罗常数的值,晶胞参数为anm,则晶体密度为__g·cm-3(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Al2O3样品中含有一定量的Cu、Fe、Fe2O3杂质。现通过下列生产过程,从该样品中回收铁红。流程如下:
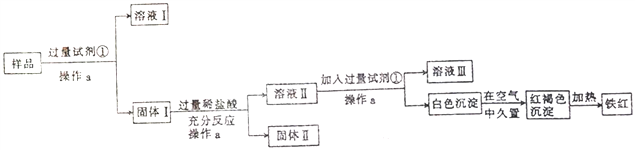
(1)操作a是________,在实验室进行该操作需要的玻璃仪器有烧杯、漏斗和_______。
(2)试剂①是_______,固体II是_________(填化学式)。
(3)红褐色沉淀的成分是_________;写出白色沉淀转化为红褐色沉淀的化学方程式:______________。
(4)溶液II中铁元素的存在形式是_______(填离子符号),如何用实验证明:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

Ⅰ.(1)从碘水中分离出I2,选择装置_______,该分离方法的名称为_________。
(2)写出上图中仪器①的名称___________________ ;
(3)冷凝管中冷却水的方向为________________________ 。
Ⅱ.实验室要配制2mol/L稀硫酸240mL。
(1)量取18.4mol/L的浓硫酸时,用下面那种规格的量筒___(填序号)
①10mL ②50mL ③100mL ④500mL
(2)配制该稀硫酸时使用的仪器除量筒、烧杯外,还必须用到的仪器有玻璃棒、胶头滴管、________。
(3)在配制过程中,如果出现下列情况,将对所配溶液的物质的量浓度有何影响?(填“偏高”、“偏低”或“无影响”)
①用量筒量取浓硫酸时,仰视量筒进行读数________;
②定容时,液面超过刻度线后用胶头滴管吸至液面处______;
Ⅲ.200mL 5mol/L NaOH溶液中,取出20mL溶液,其溶质的质量是___________;将取出的溶液稀释至100mL,其溶质的物质的量浓度是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子中,VSEPR(价层电子对互斥理论)模型名称与分子或离子的空间构型名称不一致的是
A.CO2B.CO32-C.H2OD.CC14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
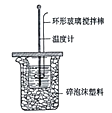
A. 如上图所示是测定中和热的简易装置,大小两烧杯间填满碎泡沫塑料的作用是固定小烧杯
B. 若用50 mL 0.55 mol·L-1的氢氧化钠溶液,分别与50 mL 0.50 mol·L-1的盐酸和50 mL0.50 mol·L-1的硫酸充分反应,两反应测定的中和热不相等
C. 实验时需要记录初始温度T1和最高温度T2
D. 做一次实验根据公式即可得出中和反应的反应热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com