
【题目】(1)书写浓硫酸与木炭在加热条件下的化学方程式为__________。
(2)试用下列各装置设计一个实验,验证上述反应所产生的各种产物。 这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号):__________→__________→__________→__________。
(3)实验时可观察到装置①中A瓶的溶液褪色,证明___________,B瓶溶液的作用____________,C瓶的溶液有___________现象,证明____________。
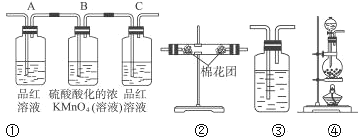
(4)书写B中的离子方程式____________。B中放置溴水不如高锰酸钾的原因____________________________。
(5)装置③中所盛溶液是__________,可验证的产物是__________。
【答案】C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O ④ ② ① ③ 产物中存在二氧化硫 将产物中的二氧化硫氧化除尽 溶液不褪色 二氧化硫已被除尽 5SO2+2MnO4-+2H2O=2Mn2++4H++5SO42- 溴单质在水溶液中的溶解度较小,可能无法完全氧化二氧化硫 澄清石灰水 CO2
2SO2↑+CO2↑+2H2O ④ ② ① ③ 产物中存在二氧化硫 将产物中的二氧化硫氧化除尽 溶液不褪色 二氧化硫已被除尽 5SO2+2MnO4-+2H2O=2Mn2++4H++5SO42- 溴单质在水溶液中的溶解度较小,可能无法完全氧化二氧化硫 澄清石灰水 CO2
【解析】
碳和浓硫酸在加热条件下反应生成SO2、CO2和水,检验二氧化碳和二氧化硫时用到的溶液中均含有水,首先用无水硫酸铜检验产物水, SO2和CO2均能使澄清石灰水变浑浊,故应先用B中品红溶液检验二氧化硫,后用澄清石灰水检验二氧化碳,在用澄清石灰水检验CO2之前必须把SO2吸收干净,酸性高锰酸钾溶液用于吸收SO2,C中品红溶液用于检验SO2是否除干净.
(1)浓硫酸与木炭在加热条件下的化学方程式为C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O;
2SO2↑+CO2↑+2H2O;
(2)由上述分析可以知道,装置的连接顺序(按产物气流从左到右的方向)是:④→②→①→③;
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色,A瓶溶液的作用是:检验产物中的SO2,B瓶溶液的作用是:将SO2全部氧化吸收,C瓶溶液的作用是:确定产物中SO2已被B瓶溶液全部氧化;
(4)B中酸性高锰酸钾将二氧化硫氧化,方程式为5SO2+2MnO4-+2H2O=2Mn2++4H++5SO42-,B中放置溴水不如高锰酸钾的原因是溴单质在水溶液中的溶解度较小,可能无法完全氧化二氧化硫;
(5)装置③可用来验证产物二氧化碳,可盛装的药品为澄清石灰水。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】复旦大学的王永刚教授研究团队在柔性电池研究方面取得了新突破,发展了一种基于有机物电极材料的柔性水系锌电池。充放电过程中实现了芘四酮(PTO)与PTO-Zn2+的相互转化,原理如图所示。下列说法正确的是
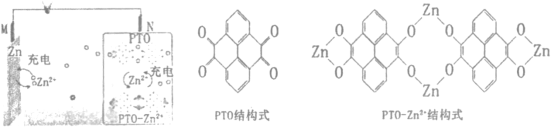
A.放电吋,N电极发生氧化反应
B.放电时,N极的电极反应式为PTO-Zn2+-8e-=2PTO+4Zn2+
C.充电时,M电极与电源负极相连
D.充电时,Zn2+向N极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是一种二元弱酸,可用作还原剂、沉淀剂等。某校课外小组的同学设计利用C2H2气体制取H2C2O4·2H2O。回答下列问题:
(1)甲组的同学以电石(主要成分CaC2,少量CaS及Ca3P2杂质等)为原料,并用下图1装置制取C2H2。

①电石与水反应很快,为了减缓反应速率,装置A中除用饱和食盐水代替水之外,还可以采取的措施是__________(写一种即可)。
②装置B中,NaClO将H2S、PH3 氧化为硫酸及磷酸,本身被还原为NaCl,其中PH3被氧化的离子方程式为______。该过程中,可能产生新的杂质气体Cl2,其原因是: _____________(用离子方程式回答)。
(2)乙组的同学根据文献资料,用Hg(NO3)2作催化剂,浓硝酸氧化C2H2制取H2C2O4·2H2O。制备装置如上图2所示:
①装置D中多孔球泡的作用是______________________。
②装置D中生成H2C2O4的化学方程式为____________________________。
③从装置D中得到产品,还需经过_____________(填操作名称)、过滤、洗涤及干燥。
(3)丙组设计了测定乙组产品中H2C2O4·2H2O的质量分数实验。他们的实验步骤如下:准确称取m g产品于锥形瓶中,加入适量的蒸馏水溶解,再加入少量稀硫酸,然后用c mol·L-1酸性KMnO4标准溶液进行滴定至终点,共消耗标准溶液V mL。
①滴定终点的现象是______________________。
②滴定过程中发现褪色速率开始很慢后逐渐加快,分析可能的原因是_______________。
③产品中H2C2O4·2H2O的质量分数为_______________(列出含 m、c、V 的表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用浓度为0.1000 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.1000 mol·L-1的三种酸HX、HY、HZ,滴定曲线如下图所示。下列说法错误的是
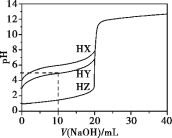
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HX<HY<HZ
B.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+)
C.根据滴定曲线,可得知Y-的水解常数K约为10-9
D.由图象可知酸碱中和滴定分析不适用于极弱的酸和极弱的碱的测定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成,一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见下表:

(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取,①分离出甲醇的操作是的______;②萃取用到的分液漏斗使用前需__________________并洗净,分液时有机层在分液漏斗的________填(“上”或“下”)层;
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是__,用饱和食盐水洗涤的目的是______;
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是__(填字母);
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤.为了防止倒吸,减压过滤完成后应先________________,再______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于如下反应,其反应过程的能量变化示意图如图:
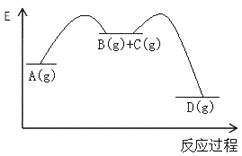
编号 | 反应 | 平衡常数 | 反应热 |
反应① | A(g)=B(g)+C(g) | K1 | △H1 |
反应② | B(g)+C(g)=D(g) | K2 | △H2 |
反应③ | A(g)= D(g) | K3 | △H3 |
下列说法正确的是
A.K3 =K1 + K2B.△H3=△H1+△H2
C.加催化剂,反应①的反应热降低,反应速率加快D.则增大压强,K1减小,K2增大,K3不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 是原子序数依次增大的短周期主族元素, 且 X、Z 原子序数之和是 Y、W 原子序数之和的![]() 。甲、乙 、丙、丁是由这些元素组成的二元化合物, M 是某种元素对应的单质, 乙和丁的组成元素相同, 且乙是一种“绿色氧化剂”, 化合物 N 是具有漂白性的气体(常温下)。上述质物间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是:
。甲、乙 、丙、丁是由这些元素组成的二元化合物, M 是某种元素对应的单质, 乙和丁的组成元素相同, 且乙是一种“绿色氧化剂”, 化合物 N 是具有漂白性的气体(常温下)。上述质物间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是:
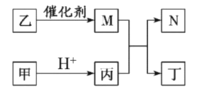
A.沸点:丁>丙,热稳定性:丁>丙
B.原子半径: r(Y) > r(Z) > r(W)
C.Z 与 X、Y、W 形成的化合物中,各元素均满足 8 电子结构
D.化合物N 与乙烯均能使溴水褪色, 且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述正确的是
A.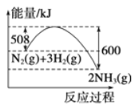 反应达到平衡后,升高温度,平衡常数K值变大
反应达到平衡后,升高温度,平衡常数K值变大
B.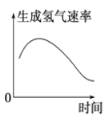 表示镁条放入盐酸中生成氢气速率随时间的变化
表示镁条放入盐酸中生成氢气速率随时间的变化
C.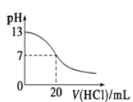 表示25 ℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1氨水,溶液的pH随加入盐酸体积的变化
表示25 ℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1氨水,溶液的pH随加入盐酸体积的变化
D.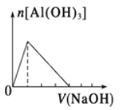 表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化
表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如下图所示。反应原理为:CH3CH2OH+O2=CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法正确的是( )
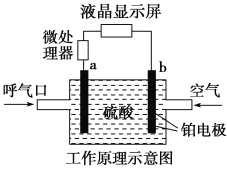
A.电解质溶液中的H+移向a电极
B.b为正极,电极反应式为:O2+4H++4e-=2H2O
C.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气
D.呼出气体中酒精含量越高,微处理器中通过的电流越小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com