
 如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )
如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 | |
| C. | 实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率 | |
| D. | 采用长玻璃导管有导气兼冷凝的作用 |
分析 由乙醇、乙酸和浓硫酸来制取乙酸乙酯,先加乙醇,后加浓硫酸,最后加乙酸,试管b中碳酸钠溶液可吸收乙醇、除去乙酸,降低乙酸乙酯的溶解度,加热可加快反应速率,长导管可冷凝回流,充分利用原料,以此来解答.
解答 解:A.向a试管中先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸,防止乙酸挥发,提高反应物的利用率,故A错误;
B.乙醇、乙酸易溶于水,则试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象,故B正确;
C.实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率,乙酸乙酯蒸出,利用化学平衡正向移动,故C正确;
D.乙酸、乙醇均易挥发,采用长玻璃导管有导气兼冷凝的作用,可充分利用原料,故D正确;
故选A.
点评 本题考查有机物的制备实验,为高频考点,把握物质的制备原理、性质、物质的检验为解答的关键,侧重分析与实验能力的考查,注意选项A为解答的易错点,题目难度不大.


科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:推断题
某芳香烃A,分子式为C8H10,B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物Y,以Y为单体可以合成高分子化合物。某烃类衍生物X,分子式为C15H14O3,遇FeCl3溶液显紫色;J分子内有两个互为对位的取代基。在一定条件下有如下的转化关系(无机物略去):

(1)一种属于芳香烃类的A的同分异构体,其苯环上的一氯代物仅有一种,其结构简式为 。
(2)J中所含的含氧官能团的名称为__________________。
(3)E与H反应的化学方程式是_______________,反应类型是_____________。
(4)已知J有多种同分异构体,写出一种符合下列性质的J的同分异构体的结构简式:_________________________。
① 与FeCl3溶液作用显紫色
② ②与新制Cu(OH)2悬浊液作用产生红色沉淀
③ ③苯环上的一卤代物有2种
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
已知H3PO2(次磷酸)是一种精细磷化工产品,要求密封阴凉保存。工业制备原理如下:
(I)2P4+3Ba(OH)2+6H2O===3Ba(H2PO2)2+2PH3↑
(II)Ba(H2PO2)2+H2SO4===BaSO4↓+2H3PO2
下列推断不正确的是( )
A.反应I是氧化还原反应,反应II是非氧化还原反应
B.H3PO2具有强还原性,高温时在空气可能被氧化成磷酸
C.在反应I中氧化剂与还原剂的质量之比为1∶1
D.在标准状况下生成2.24 L PH3,上述反应转移0.3 mol电子
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
在Cu+4HNO3(浓)= Cu(NO3)2+2NO2↑+2H2O,下列有关该反应说法正确的是
A.硝酸表现出了氧化性和酸性 B.还原剂与氧化剂之比为1:4
C.每个硝酸分子得到2个电子 D.硝酸铜是还原产物
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
氢化钙可以作为生氢剂(其中CaH2中氢元素为-1价),反应方程式如下:
CaH2 + 2H2O===Ca(OH)2 + 2H2↑,其中水的作用是
A.既不是氧化剂也不是还原剂 B.是氧化剂
C.是还原剂 D.既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
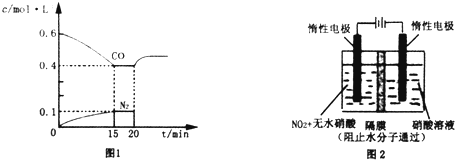
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
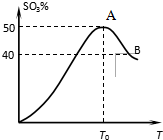 在体积为2L密闭 绝热容器中,将物质的量均为2.00mol的SO2、O2混合,发生如下反应:2SO2(g)+O2(g)?2SO3(g),容器中SO3的体积分数
在体积为2L密闭 绝热容器中,将物质的量均为2.00mol的SO2、O2混合,发生如下反应:2SO2(g)+O2(g)?2SO3(g),容器中SO3的体积分数 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com