
【题目】辉铜矿(主要成分是Cu2S)是冶炼铜的主要原料,辉铜矿样品的纯度可以用酸性高锰酸钾溶液滴定来测定,该反应可表示为Cu2S+ ![]() +H+→Cu2++
+H+→Cu2++ ![]() +Mn2++H2O(未配平)。下列说法中不正确的是( )
+Mn2++H2O(未配平)。下列说法中不正确的是( )
A.Cu2S为还原剂被氧化, ![]() 为氧化剂被还原
为氧化剂被还原
B.氧化剂和还原剂物质的量之比为2∶1
C.反应中每消耗1 mol Cu2S,转移8 mol电子
D.滴定时可以不加其他的指示剂
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列回答: 
(1)实验中观察到的现象是 .
A.试管中镁片逐渐溶解
B.试管中产生无色气泡
C.烧杯外壁变冷
D.烧杯底部析出少量白色固体
(2)试管中发生的反应属于(选填“氧化还原反应”或“非氧化还原反应”).
(3)写出有关反应的离子方程式 .
(4)由实验推知,MgCl2溶液和H2的总能量(填“大于”“小于”“等于”)镁片和盐酸的总能量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 第IA族又叫碱金属元素,第VIIA族元素又叫卤族元素,0族元素又叫稀有气体元素
B. Ba(OH)2碱性比Ca(OH)2强
C. 元素周期表有7个主族,7个副族,1个0族,1个第Ⅷ族,共18纵行
D. X2+的核外电子数目为18,则X在第四周期第ⅡA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的实验装置中,A、F分别为NH3和Cl2的发生装置. 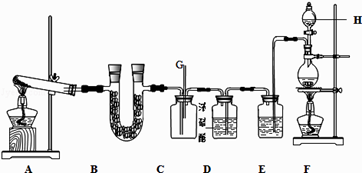
请回答下列问题:
(1)装置F中发生反应的离子方程式为 .
(2)甲、乙两同学分别采用下列两种方案制取C12:甲:用含HCl 146g的浓盐酸与足量的MnO2反应.乙:用87g MnO2与足量浓盐酸反应.则所得氯气(填字母). a.甲比乙多b.乙比甲多c.一样多
(3)仪器H的名称是(填名称),装置E的作用是 .
(4)装置C的导管G处逸出的尾气中可能含有黄绿色的有毒气体,可用进行尾气处理(填选用试剂的名称).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物.则下列说法错误的是( ) 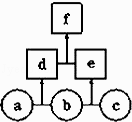
A.常温下,单质a呈气态
B.单质c具有强氧化性
C.稳定性:d>e
D.f受热易分解为d和e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图如下。下列说法不正确的是( )
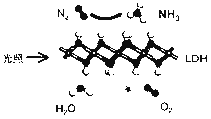
A. 该过程将太阳能转化成为化学能 B. 该过程中,涉及极性键与非极性键的断裂与生成
C. 氧化产物与还原产物的物质的量之比为3∶4 D. 该反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是( )
A.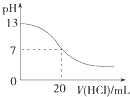 图表示25℃时,用0.1 molL﹣1盐酸滴定20 mL 0.1 molL﹣1 NaOH溶液,溶液的pH随加入酸体积的变化
图表示25℃时,用0.1 molL﹣1盐酸滴定20 mL 0.1 molL﹣1 NaOH溶液,溶液的pH随加入酸体积的变化
B.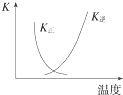 图中曲线表示反应2SO2(g)+O2(g)2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化
图中曲线表示反应2SO2(g)+O2(g)2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化
C.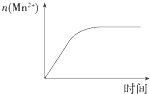 图表示10 mL 0.01 molL﹣1 KMnO4酸性溶液与过量的0.1 molL﹣1 H2C2O4溶液混合时,n(Mn2+)随时间的变化
图表示10 mL 0.01 molL﹣1 KMnO4酸性溶液与过量的0.1 molL﹣1 H2C2O4溶液混合时,n(Mn2+)随时间的变化
D.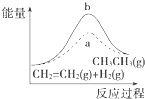 图中a、b曲线分别表示反应CH2═CH2(g)+H2(g)﹣→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化
图中a、b曲线分别表示反应CH2═CH2(g)+H2(g)﹣→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8).下列说法错误的是( )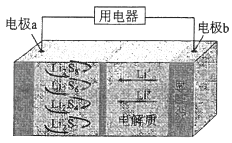
A.电池工作时,正极可发生反应:2Li2S6+2Li++2e﹣=3Li2S4
B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g
C.石墨烯的作用主要是提高电极a的导电性
D.电池充电时间越长,电池中的Li2S2量越多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com